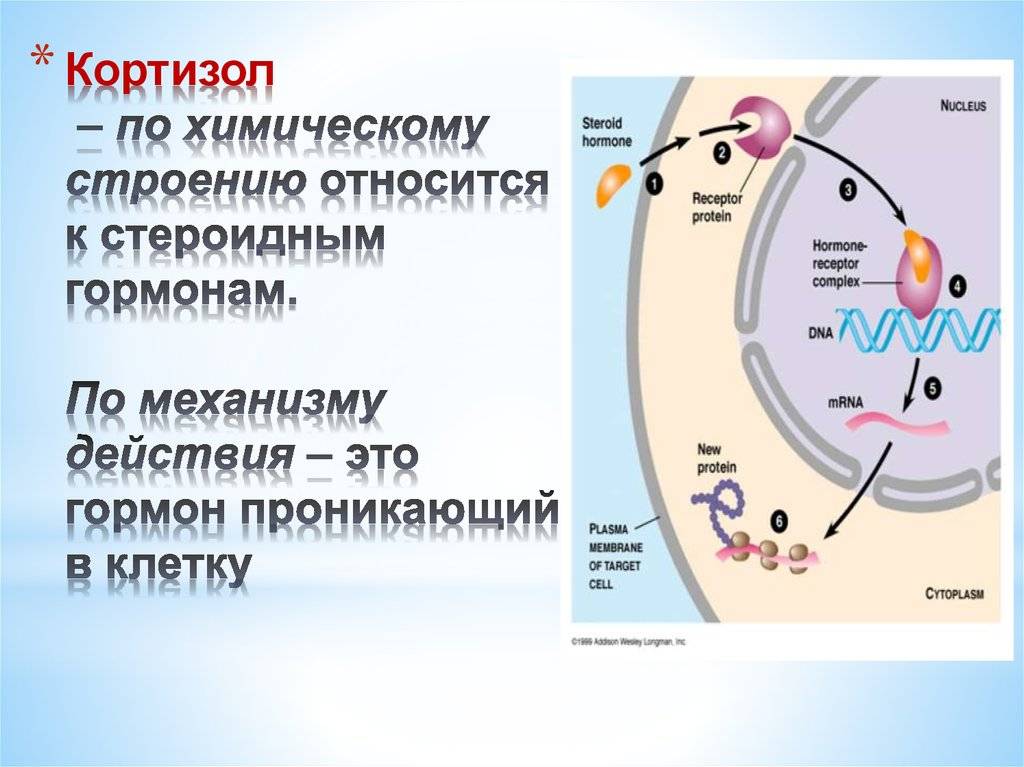
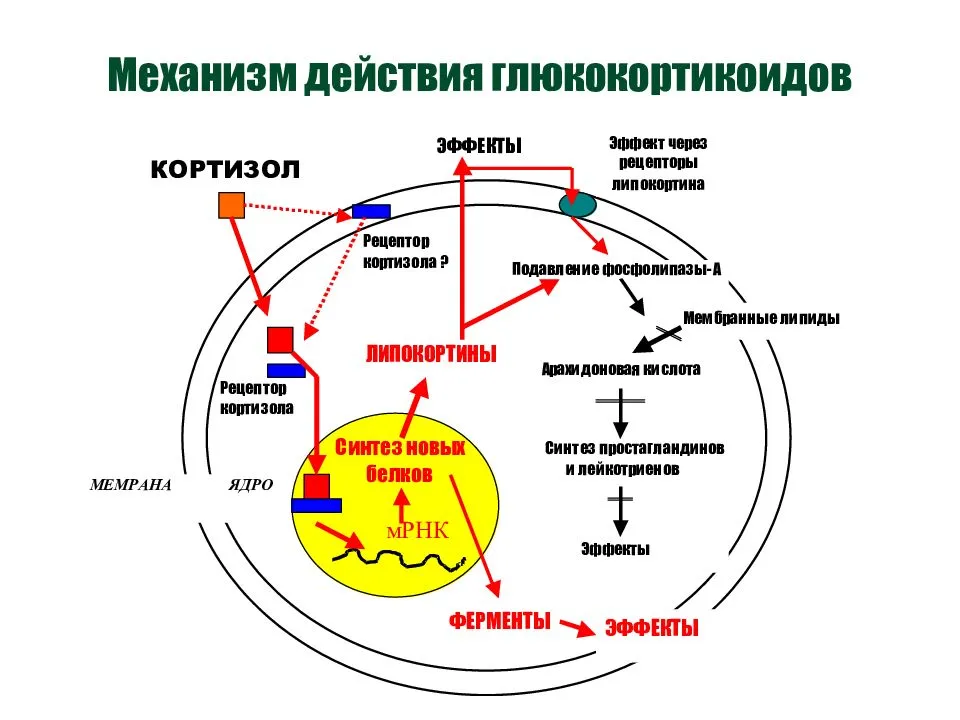
Введение
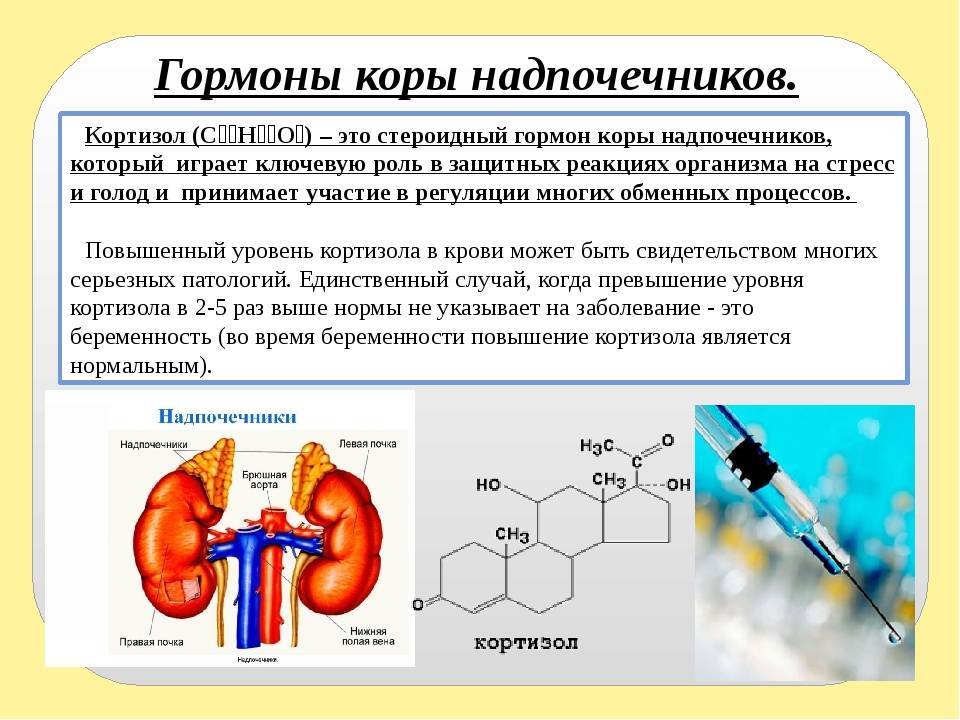
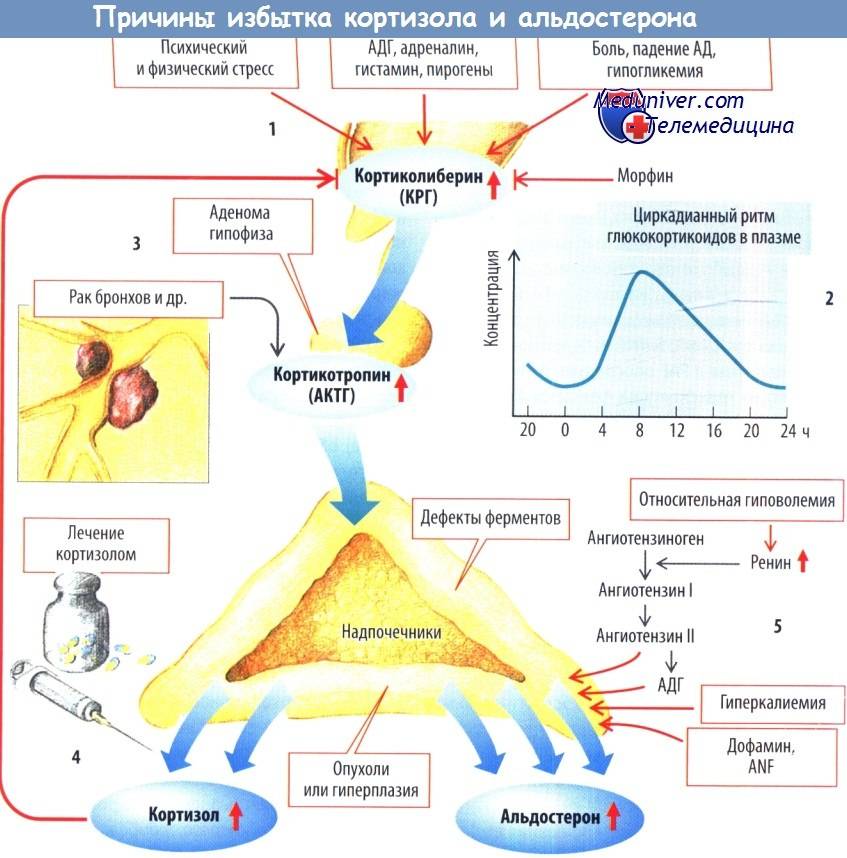
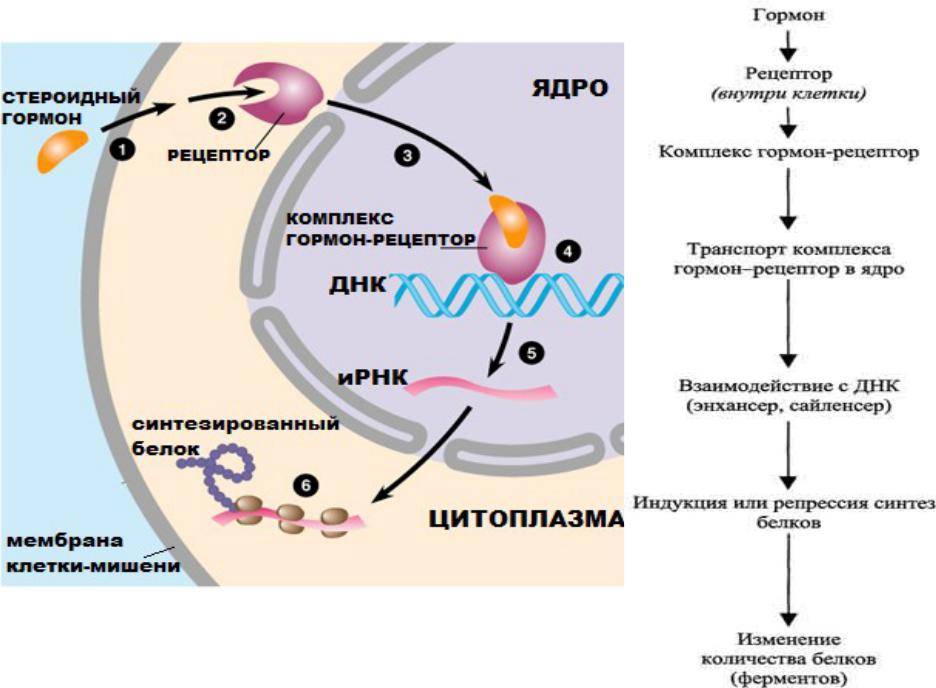
В основе любого научного открытия лежит накопление большого количества клинических наблюдений, литературных данных с последующей суммацией и систематизацией знаний и выдвижением новой гипотезы. В настоящее время имеется достаточное количество информации о механизмах действия кортизола и его клеточных мишенях, локального и системного действия, однако продолжающиеся экспериментальные исследования открывают все больше новых данных о биологической роли гормона. Исходным субстратом в стероидогенезе служит холестерин, либо получаемый с пищей, либо синтезируемый эндогенно из ацетата. Три основных пути биосинтеза в корковом веществе надпочечников приводят к образованию глюкокортикоидов, минералокортикоидов и надпочечниковых андрогенов. Наружная (клубочковая) зона участвует преимущественно в биосинтезе альдостерона, а внутренние (пучковая и сетчатая) служат местом биосинтеза глюкокортикоидов и андрогенов. Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15–30 мг и обладает выраженным суточным ритмом. Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связывается специфическим белком (а2-глобулином) – транскортином, обладающим высоким средством к гормону. Менее 5% кортизола связывается белком с низким сродством – альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. В норме глюкокортикостероиды (ГКС) участвуют во всех видах обмена (в метаболизме белков, углеводов, липидов), в связи с чем патофизиологические и клинические изменения при гиперкортицизме колеблются в широких пределах. Гиперпродукция глюкокортикоидов может быть следствием повышения уровня адренокортикотропного гормона при опухолях гипофиза (болезнь Иценко-Кушинга), опухолях, происходящих из других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола корой надпочечников (синдром Иценко-Кушинга). На примере этих орфанных заболеваний изучены различные эффекты избытка кортизола на органы и ткани. При гиперкортицизме наблюдаются нарушение толерантности к глюкозе или сахарный диабет, обусловленные стимуляцией глюконеогенеза и развитием инсулинорезистентности, усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани, своеобразное перераспределение и изменения морфологического состава жировой ткани. Как известно, глюкокортикоиды моделируют физиологию жировой ткани, изменяя секрецию адипокинов непосредственно или в связи с развивающейся инсулинорезистентностью, стимулируют дифференцировку адипоцитов, способствуя образованию новых клеток жировой ткани посредством активации транскрипции ряда ключевых генов . Гипернатриемия, гипокалиемия и, как следствие, артериальная гипертензия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Как показывают данные исследований, при ожирении и сахарном диабете (СД) 2 типа нередко обнаруживается функциональный гиперкортицизм, не обусловленный гиперпродукцией гормона опухолевой тканью. По данным Всемирной организации здравоохранения, в 2007 г. в мире зарегистрировано 523 млн больных ожирением. ВОЗ прогнозирует, что к 2025 г. половина населения планеты будет иметь избыточный вес . По данным международной федерации диабета (IDF), распространенность СД среди взрослого населения планеты (20–79 лет) составляет около 9% или, в абсолютных цифрах, 415 млн человек. По прогнозам экспертов, к 2040 г. их число достигнет 642 млн. Неуклонный рост числа пациентов с СД (преимущественно 2 типа) и ожирением ставит новые задачи по разработке эффективных лекарственных средств и форм их доставки, методов своевременного выявления и профилактики развития заболевания.
Какие гормоны участвуют в работе желез внутренней секреции: вот откуда все наши беды
Многие пациентки, обратившиеся к гинекологу — эндокринологу удивляются, когда им предлагают пройти сразу несколько анализов на гормоны. Они почему-то думают, что их здоровье зависит только от пары-тройки половых гормонов и инсулина. На самом деле эндокринными железами женщины вырабатывается около 70 гормонов. И каждый из них очень важен для организма.
По химическому составу гормональные вещества относят к 3 группам:
Белково-пептидные. Это гормоны, вырабатываемые гипоталамусом, синтезирующиеся из белковых соединений. Они имеют широкий спектр действия:
- стимулируют сокращение гладкой мускулатуры и отвечают за транспортировку воды (окситоцин);
- стимулируют образование пигментов кожи;
- отвечают за углеводный обмен (инсулин, глюкагон);
- регулируют фосфорно-кальциевый обмен (тиреокальцитонин);
- способствуют ожирению или похуданию (липотропный гормон);
- отвечает за образование молока во время вскармливания (лактогенный гормон);
- участвуют в производстве половых клеток, отвечают за менструальный цикл (лютеинизирующий, тиреотропный, фолликулостимулирующий гормоны).
Белково-пептидные гормоны воздействуют на корки надпочечников, щитовидной железы, половых желез, стимулируя их работу. Сбой в выработке белково-пептидных гормонов приводит к нарушению в работе различных внутренних органов.
Производные аминокислот. Они являются производными L-тирозина и L-триптофана. Из L-тирозина образуются гормоны надпочечников адреналин и норадреналин, которые отвечают за нормальную работу сердца, поддерживают давление и температуру тела в норме.
Производные аминокислот продуцируют гормоны, регулирующие деятельность щитовидной железы. L-триптофан синтезирует жизненно важные гормоны, отвечающие за настроение и жизненный тонус человека — гормон сна мелатонин и гормон радости серотонина. Аминокислоты отвечают за тягу к алкоголю и курению, ПМС у женщин, нормальный сон.
Стероидные. Производятся из холестерина в коре надпочечников, семенниках у мужчин и фолликулярных клетках у женщин, в плаценте у беременных.
Они имеют следующие функции:
- кортикостероидные гормоны кортизол, кортикостерон, кортизон вырабатываются корой надпочечников при стрессе или тревоге;
- женские гормоны эстрогены вырабатываются яичниками и отвечают за молодость и красоту;
- андрогены (тестостерон) продуцируются у мужчин семенниками, у женщин такж содержатся в организме, но в гораздо меньшей степени.
Самые распространенные патологии:
- Болезнь Аддисона, туберкулез и врожденная дисфункция надпочечников. В этом случае среди симптомов человек будет отмечать у себя быструю усталость и утомляемость, снижение работоспособности, слабость в мышцах. Вес будет постепенно уменьшаться, а тяга к жизни пропадать. Пациент становится пассивным, перестает радоваться жизни. При хронической недостаточности отмечается усиленная пигментация кожи в местах, где натирает одежда, становятся явно видны ореолы сосков, потемнения вокруг ануса. У больных на ранних стадиях отмечается пониженное артериальное давление. Могут быть боли в животе неясной этимологии, проявляться язвенные и другие заболевания ЖКТ. У женщин менструации становятся скудными, но длительными, вплоть до прекращения.
- Гипоитуитаризм и пангипопитуитаризм. Больные страдают резкими апатическими состояниями, вплоть до того, что не могут заставить себя встать с кровати по нескольку дней. Наблюдается сильное снижение массы тела, кожа становится сухой, шелушится, трескается, волосы будут ломкими и безжизненными, начинают выпадать. Утрата волосяного покрова наблюдается не только на голове, но и на половых органах, в подмышечных впадинах. Пропадает половое влечение, снижается пигментация сосков у женщин, происходит атрофия яичек у мужчин.
- Снижение уровня гормонов щитовидной железы. Самым распространенным заболеванием становится гипотиреоз, в совокупности с падением гормона кортизола в крови наблюдаются опасные для жизни состояния, до комы. Может наблюдаться тошнота и рвота, боли в животе, диарея, пониженная выработка желудочного сока и других секретов ЖКТ.
- Синдром Нельсона и ятрогенные заболевания. Проявляются нервозностью, нарушениями зрения, продуцируются опухоли в гипофизе. Пациенты с такими заболеваниями мнительны, быстро выходят из состояния эмоционального равновесия, подвержены депрессиям, тревогам и страхам.
- Адреногенитальный синдром. Это заболевание характеризуется повышенной выработкой мужских гормонов в организме людей обоих полов. При этом оно провоцирует рост грубых волос на лице, теле по мужскому типу.
Среди других заболеваний можно назвать опасные инфекционные болезни: СПИД, туберкулез и др. Снижение кортизола может вызвать длительный прием стероидных препаратов, а также кровоизлияния в надпочечники из-за повреждения сосудов физиологической или механической природы, гепатиты и цирроз печени.
В любом случае, когда наблюдаются эти симптомы необходимо срочно обратиться за медицинской помощью. Большинство заболеваний легко излечимы на ранних стадиях, не потребуют длительных и дорогостоящих процедур.
Ярко выраженные симптомы пониженного кортизола
Стоит посетить врача, в случаях если наблюдаются:
- плохой аппетит и резкое снижение веса;
- низкая трудоспособность;
- кружится голова, начались обмороки;
- присутствует частая тошнота, рвота, диарея;
- боль в животе неясной локализации;
- постоянно хочется соленого;
- на коже проступают пигментные пятна;
- падает тонус мышц;
- частые перепады настроения, депрессия, апатия, тревожность.
Если есть один или несколько подобных симптомов необходимо незамедлительно обратиться к специалисту.
Повышение: причины и клинические проявления
Высокий уровень кортизола в крови положительно сказывается на работе организме только тогда, когда не превышает верхних границ нормы. Это связано с его физиологическими функциями. Если гидрокортизон низкий — все биологические процессы замедляются, организм как будто впадает в спячку. При повышении происходит наоборот. Постоянное состояние стресса негативно сказывается на работе абсолютно всех органов и систем организма. Однако в отличие от пониженного, повышенный уровень гормона кортизола в крови могут вызвать вполне жизненные причины:
- длительный прием кортикостероидов;
- беременность и роды;
- очень сильное и длительное эмоциональное перенапряжение;
- гипертиреоз, нарушение работы щитовидной железы;
- лишний вес;
- длительный и частый отказ от пищи вне зависимости от причин;
- изнуряющие физические нагрузки, тренировки;
- употребление кофе, энергетиков;
- поликистоз яичников;
- прием алкоголя, курение, наркотики;
- некоторые лекарственные препараты: верошпирон, оральные контрацептивы.
Среди резко негативных патологических состояний следует выделить болезнь Иценко-Кушинга, новообразования гипофиза и коры надпочечников.
Кортизол и кардиоваскулярные риски
По данным Colao A. и соавт., в течение пяти лет после наступления ремиссии болезни Иценко-Кушинга концентрации холестерина, ЛПНП, индекс атерогенности, уровень инсулина остаются выше референсных значений, что определяет этих пациентов в группу высокого риска по сердечно-сосудистым осложнениям даже после достижения ремиссии заболевания .
Помимо перечисленных метаболических факторов, лежащих в основе кардиоваскулярных нарушений, кортизол оказывает ингибирующее действие на ангиогенез. Под ангиогенезом стоит понимать процесс роста новых кровеносных сосудов, который является необходимым в репарации тканей и при иных заболеваниях, протекающих с развитием ишемии ткани, таких как ишемическая болезнь сердца, хроническая артериальная недостаточность нижних конечностей и тд.
Регулирование ангиогенеза гипоксией является важным компонентом гомеостаза. В норме в ответ на снижение содержания кислорода в тканях, гипо ксие индуцируемый фактор Ia (HIF-1) стимулирует рост новых сосудов. Тот же механизм срабатывает и в ишемизированных тканях .
HIF-1 контролируемое производство фактора роста эндотелия сосудов (VEGF) приводит к аутокринной передаче сигнала, что имеет решающее значение для ангиогенеза. Многие из биологических процессов в ангиогенезе, инвазия внеклеточного матрикса и формирование трубки эндотелиальными клетками стимулируются в условиях гипоксии через HIF-1, который активирует транскрипцию десятков генов, чьи белковые продукты играют решающую роль в этих процессах .
Как показывают данные исследований, в процессе патологической перестройки миокарда, его гипертрофии, а затем дилятации с развитием сердечной недостаточности, одну из ключевых ролей играет HIF-1. HIF-1 стимулирует выработку VEGF, который, в свою очередь, связывается с рецептором на поверхности эндотелиальных клеток. После чего происходит активация сигнального пути ERK (Ras-ERK и MAPK/ERK), стимулирующего пролиферацию и миграцию эндотелиоцитов .
Глюкокортикоид-опосредованное ингибирование ангиогенеза играет важную роль в физиологии, патофизиологии и терапевтических подходах к некоторым заболеваниям. Тем не менее, механизмы, посредством которых глюкокортикоиды ингибируют рост новых кровеносных сосудов, до конца не изучены. В экспериментальном исследовании James J. Logie и соавт. продемонстрировано, что даже физиологические уровни глюкокортикоидов подавляют ангиогенез, непосредственно предотвращая формирование сосудистой трубки эндотелиальными клетками. В процессе ангиогенеза эндотелиальные клетки начинают активно пролиферировать, запускается процесс трансформации их морфологической структуры, что приводит к формированию высокоупорядоченных клеточных линий, составляющих внутренний слой новообразованных сосудов.
Воздействие кортизола снижает образование межклеточных контактов, не ухудшая при этом пролиферации, миграции или жизнеспособности эндотелиальных клеток. Предыдущие исследования показывают, что глюкокортикоиды подавляют ангиогенез путем ингибирования синтеза VEGF , что доказывает ингибирующее действие кортизола на сигнальные пути, который инициирует образование тубул.
Таким образом, в условиях гиперсекреции кортизола VEGF-опосредованный ангиогенез нарушается, что быстрее приводит к дезадаптации процессов компенсации сердечной деятельности и развитию тяжелой сердечной недостаточности, что и обуславливает неблагоприятный прогноз у пациентов с гиперкортицизмом любой этиологии.
Признаки острой надпочечниковой недостаточности
Различают несколько вариантов клинического течения острой надпочечниковой недостаточности:
– сердечно–сосудистая форма острой надпочечниковой недостаточности, при которой выражены явления острой недостаточности кровообращения – резкое снижение артериального давления, сопровождаемое обильным потоотделением, внезапной слабостью, чувством холода в конечностях, сердечной аритмией;
– желудочно–кишечная форма острой надпочечниковой недостаточности, симптоматика которой напоминает состояние «острого живота», с тошнотой, рвотой, диареей, резкими острыми болями в области живота;
– нервно–психическая или менингоэнцефалическая форма острой надпочечниковой недостаточности, сопровождаемая головными болями, вялостью, сбоями в работе сознания, галлюцинациями, обморочными состояниями.
При появлении подобных симптомов больной нуждается в срочной госпитализации. В чистом виде каждая из форм встречается редко, чаще бывает их сочетание. Аддисонический криз может длиться от нескольких часов до нескольких дней. До кризисного состояния больной может за очень короткое время. Симптомами приближения криза является слабость, мышечные боли и потеря аппетита. В некоторых случаях клинические симптомы острой надпочечниковой недостаточности развиваются молниеносно, без предшествующих признаков.
Кортизол и метаболический синдром
Хорошо известно, что ГКС оказывают влияние на распределение жировой ткани. Ряд исследований показал, что пациенты с ожирением имеют гиперактивацию фермента 11β-HSD1 в жировой ткани и гепатоцитах, ключевого фермента, стимулирующего конверсию метаболически неактивного кортизона в активный кортизол (рис. 1). Напротив, 11β-гидроксистероид дегидрогеназа 2 (11β-HSD2), катализирующая превращение кортизона в кортизол, имела низкую экспрессию.
Рис.1 Конверсия кортизола в кортизон
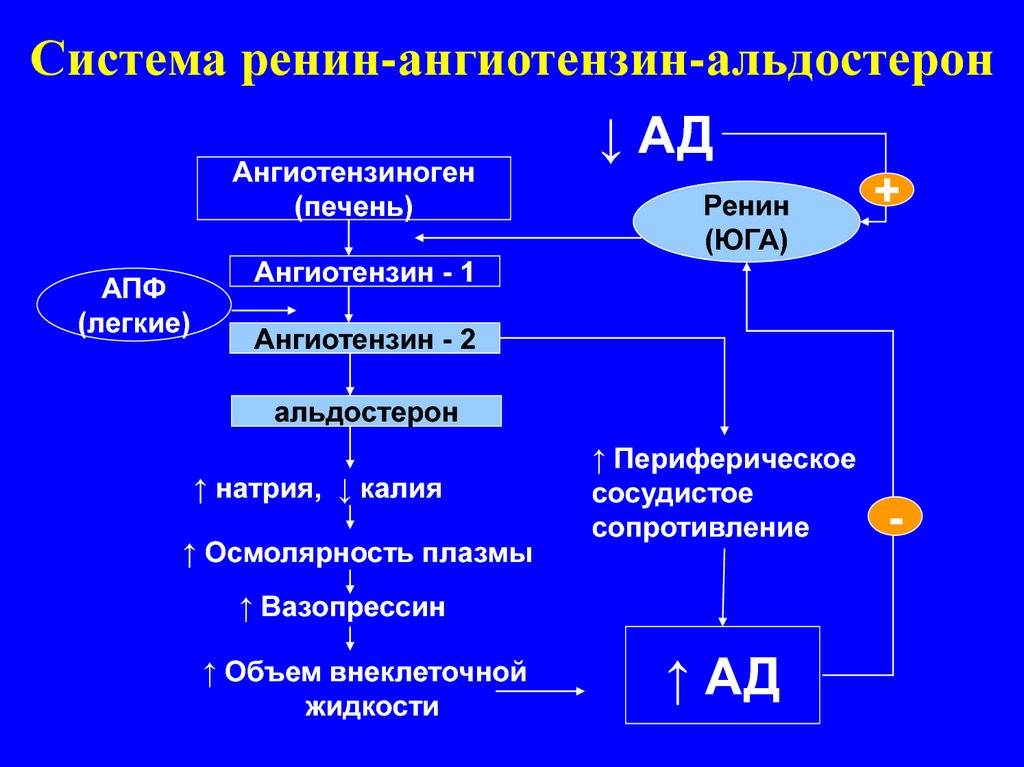
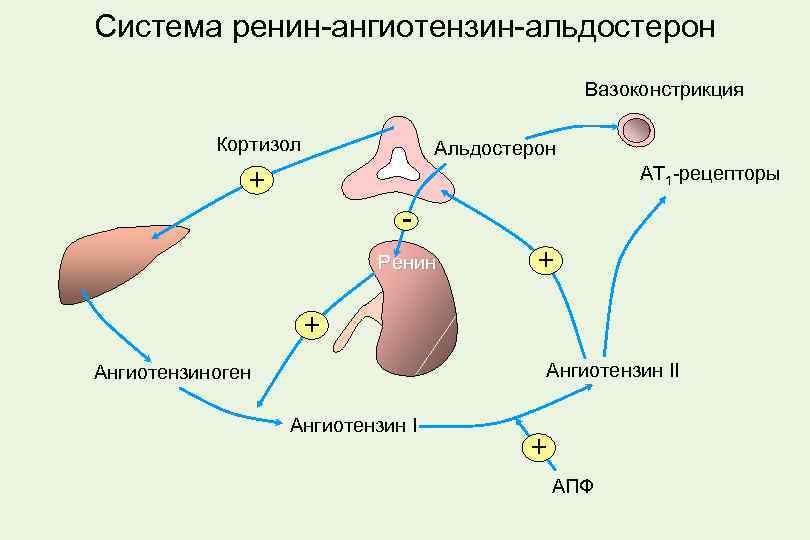
Как упоминалось ранее, было выдвинуто предположение, что активность 11β-HSD1 может быть одним из патогенетических механизмов, лежащих в основе развития метаболического синдрома. Данные экспериментальных исследований на животных показали, что селективная 11β-HSD1 гиперэкспрессия в жировой ткани (аналогично тому, что наблюдается у пациентов с ожирением) приводила к развитию метаболического синдрома, и, в частности, дислипидемии, ожирению, гипертензии, связанной с активацией системы ренин-ангиотензин-альдостерон, инсулинорезистентности и нарушению углеводного обмена. Кроме того, адипоциты имели больший размер (рис. 2), чем обычно, основной эффект наблюдался в висцеральной жировой ткани, возможно, из-за более высокой плотности рецепторов к ГКС .
Рис. 2 Электронная микрофотография адипоцитов
Полученные данные позволили рассматривать 11b-HSD1 в качестве новой мишени для фармакотерапии. II фаза рандомизированного двойного слепого плацебо-контролируемого исследования эффективности селективного ингибитора 11b-HSD1 (INCB013739) у пациентов с избыточной массой тела/ожирением и СД 2 типа показали статистически значимое увеличение печеночной и периферической чувствительности к инсулину, снижению глюкозы в плазме натощак, общего холестерина и липопротеинов низкой плотности (ЛПНП), триглицеридов плазмы и уровня АД . Открытым остается вопрос: каким образом локальная гиперпродукция ГКС влияет на системный уровень кортизола и нарушается ли при этом механизм отрицательной обратной связи?
Механизм развития острой надпочечниковой недостаточности
Любая форма надпочечниковой недостаточности развивается в результате сбоя в секреции гормонов коры надпочечников, в особенности кортизола и альдостерона, недостаток которых ведет к нарушению калий–натриевого обмена, снижению объема крови, что чревато целым рядом расстройств со стороны сердечно-сосудистой и пищеварительной систем. У пациентов с надпочечниковой недостаточностью центрального генеза за счет сохранения нормального уровня выработки альдостерона нарушения электролитного баланса и обезвоживание выражены гораздо меньше.
Механизм развития острой надпочечниковой недостаточности связан с резким снижением до критического уровня или полным прекращением выработки глюкокортикоидных гормонов корой надпочечников. Из-за дефицита минералокортикоидных гормонов развивается циркуляторная недостаточность, приводящая к гиповолемическому шоку, возникающему в результате снижения уровня натрия в крови и затем – объема циркулирующей крови.
При синдроме отмены глюкокортикоидных гормонов механизм развития острой надпочечниковой недостаточности связан с блокировкой выработки нормального уровня адренокортикотропного гормона из-за длительного подавления его выработки.
Острая надпочечниковая недостаточность, возникшая на фоне геморрагического инфаркта надпочечников, связана с тем, что на фоне повышенной концентрации бактерий и их эндотоксинов в крови происходит выброс медиаторов воспаления, оказывающих повреждающее воздействие на внутреннюю сосудистую стенку, приводящее к образованию тромбов внутри сосудов, которые влекут за собой кровоизлияния во внутренних органах и на коже.
Методы диагностики острой надпочечниковой недостаточности
Для выявления острой надпочечниковой недостаточности прежде всего необходимо собрать анамнез и выяснить у больного наличие заболеваний надпочечников или гипофиза (хронической надпочечниковой недостаточности, врожденной дисфункции коры надпочечников, опухолей надпочечников, синдрома Кушинга, оперативных вмешательств на гипофизе и т.п.)
При осмотре больного отмечают бледность кожных покровов, синюшность конечностей, снижение артериального давления, учащение сердцебиения, нитевидный пульс, снижение объема мочи, тошноту с неукротимой рвотой, кровавый понос, вздутие живота. Если преобладает нервно–психическая форма острой надпочечниковой недостаточности, у больного при физикальном обследовании выявляется очаговая неврологическая симптоматика, ступор, заторможенность, головные боли.
При осмотре кожных покровов у пациентов может обнаруживаться звездчатая геморрагическая сыпь, либо сыпь в виде петехий.
Повышение температуры тела для адиссонического криза нехарактерно, за исключением наличия сопутствующего инфекционного процесса или выраженного обезвоживания организма.
Лабораторные методы исследования острой надпочечниковой недостаточности сводятся к исследованиям:
– общего анализа крови, в котором может отмечаться относительный лимфоцитоз, повышение уровня СОЭ, эозинофилия;
– биохимического анализа крови, позволяющего выявить снижение уровня натрия и повышение уровня калия, а также снижение концентрации глюкозы в крови;
– уровня гормонов – кортизола и ренина, а также содержания адренокортикотропного гормона, уровень которого, как правило, повышается при первичной острой надпочечниковой недостаточности, а при вторичной – остается неизменным или несколько снижается. Порой для выявления причины развития острой надпочечниковой недостаточности целесообразно сделать посев крови, что позволит выявить септическое состояние, и коагулограмму, которая даст информацию о свертывании крови и возможности развития тромбов.
Из инструментальных методов исследования для диагностики острой надпочечниковой недостаточности наиболее информативны электрокардиография (позволяет выявить аритмии), рентгенография (для исключения травм и воспалительных процессов в легких), ультразвуковое исследование брюшной полости (для выявления инфекционного очага) и компьютерная или магнитно–резонансная томография.
Необходимо при диагностике отличить острую надпочечниковую недостаточность от острой недостаточности кровообращения другого происхождения, острого аппендицита, холецистита, панкреатита, кишечной непроходимости, прободения язвы желудка или двенадцатиперстной кишки.
Как определяют уровень фолликулостимулирующего гормона?
Перед тем как определить причину повышенного ФСГ, врач должен узнать точную его концентрацию. Для этого пациент сдает образец крови из вены. Перед исследованием необходимо выполнить несколько рекомендаций. В частности, за несколько дней до сдачи анализа необходимо исключить тяжелые физические нагрузки, а в день сдачи — отказаться от курения, не принимать пищу, не пить кофе, сок, чай. Женщинам необходимо планировать анализ на 2–5 день менструального цикла при отсутствии других рекомендаций.
Для определения точной причины повышенного ФСГ может быть назначено дополнительное обследование: МРТ головного мозга, УЗИ органов малого таза и брюшной полости, дополнительные лабораторные анализы и др. У женщин часто определяется соотношение фолликулостимулирующего и лютеинизирующего гормона.