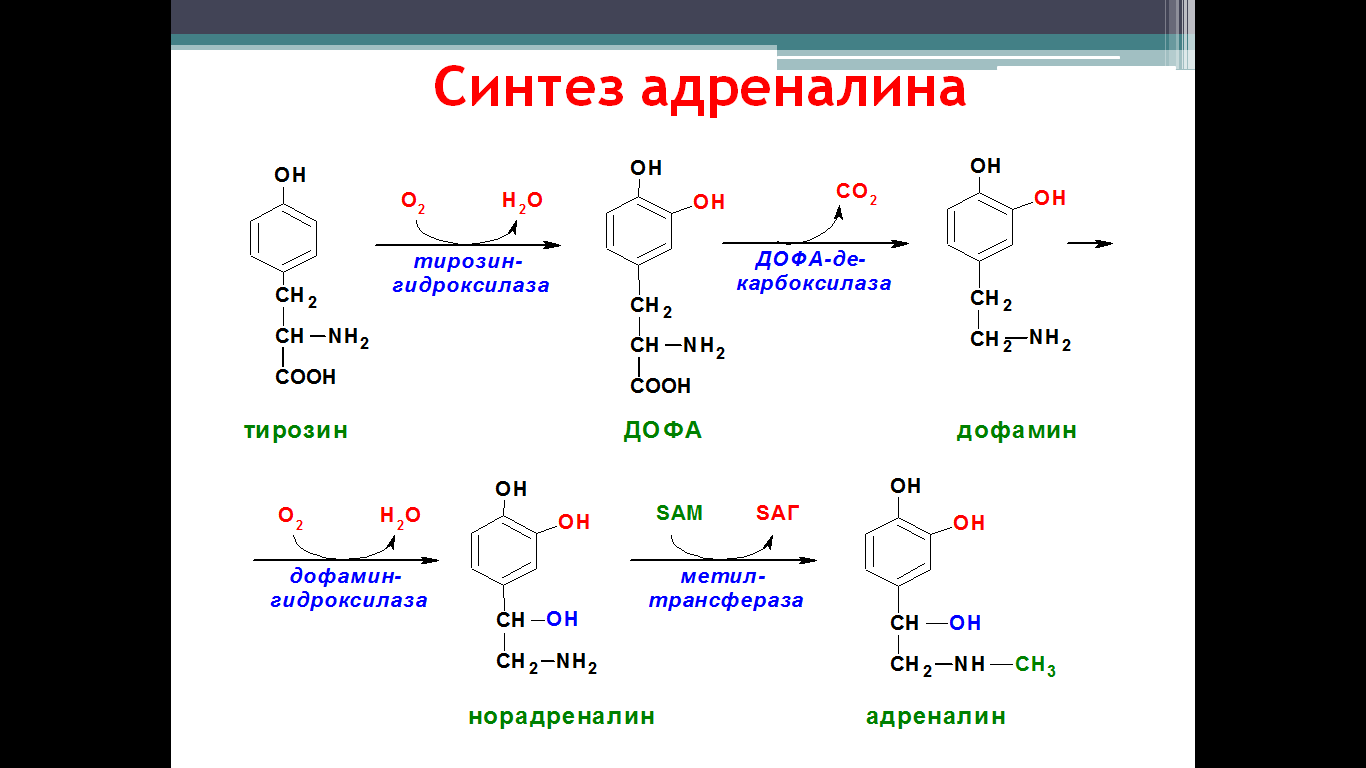
Как молоко провоцирует акне
Исследователи сходятся во мнении, что вероятная причина – содержание в молочных продуктах гормонов, вырабатываемых коровами во время беременности1.
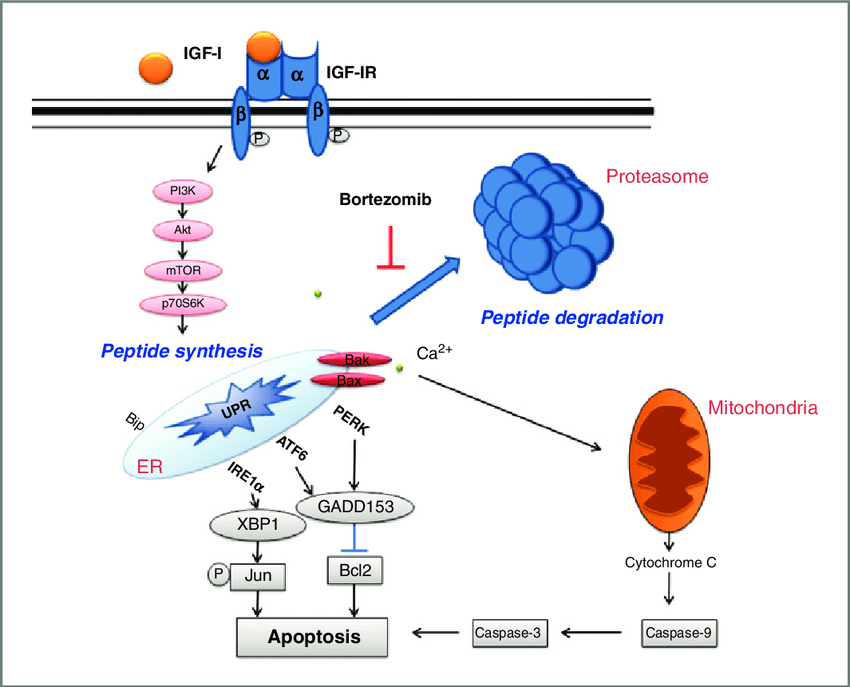
Инсулиноподобный фактор роста 1 (IGF-1)
Считается, что он стимулирует волосяной фолликул и себоциты, что приводит к развитию воспаления. Рецепторы IGF-1 расположены в кератиноцитах эпидермиса и представляют собой единичные трансмембранные рецепторы, которые отвечают за активность тирозинкиназы.
Концентрация IGF-1 в крови варьируется в зависимости от тяжести угревой болезни2. В молоке и молочных продуктах содержится казеин – он стимулирует выработку IGF-1 в печени, впоследствии повышая его уровень в плазме3. Высокий уровень возбуждает себоциты, что приводит к прогрессу акне.
Самые высокие концентрации IGF-1 обнаружены у женщин с акне, а количество воспалительных элементов положительно коррелировало с уровнями IGF-1 в плазме4.
В период полового созревания уровни IGF-1 увеличиваются под влиянием гормона роста, и это ухудшает течение акне.
Андрогены
IGF-1 стимулирует синтез андрогенов яичниками и яичками и ингибирует печеночный синтез связывающего половые гормоны глобулина. У пациентов с угревой болезнью наблюдалась положительная корреляция между концентрациями IGF-1, сульфата дегидроэпиандростерона, дигидротестостерона, количеством воспалительных элементов и секрецией кожного сала5. Его производство увеличивалось6.
Дигидротестостерон (DHT)
Молоко из магазинов богато не только прогестероном, полученным из плаценты, но и другими предшественниками дигидротестостерона – 5α-прегнандион и 5α-андростандион7. Молоко содержит 5α-восстановленные стероиды, которые являются предшественниками DHT. Предполагается, что они повышают комедогенность, стимулируя выработку кожного сала и вызывая гиперкератинизацию5. Они богаты глюкокортикоидами, трансформирующим фактором роста-b (TGF-b) и пептидами, вырабатывающими тиреотрофин-рилизинг-гормон, а также йод, которые могут влиять на себоциты8.
Фактор транскрипции FOXO1
Исследования, проведенные американскими дерматологами, показали, что молоко и молочные продукты через IGF-1 / путь фосфинозитид-3-киназы (PI3K)/Akt модулирует FoxO1, что усугубляет воспаление9. Установлено, что FoxO1 регулирует работу генов, ассоциированных с акне, и секрецию сальных желез, и его активация играет важную роль в патогенезе.
FoxO1 модулирует комплекс mTORC1, который также участвует в активации себоцитов и акнегенезе. Молоко увеличивает и уровни аминокислот с разветвленной цепью (BCAA), которые стимулируют активность mTORC10.
Рецептор инсулина, рецептор к ИФР-1 и резистентность к сигнальному пути инсулина
В основе сигнального пути инсулина (и его резистентности) лежат тирозинкиназные рецепторы инсулина и ИФР-1.
- Эти рецепторы притягивают молекулы, содержащие SH2-домен (несколько док-сайтов для форфорилированных тирозинов) —
- Белки, которые также могут связываться с рецептором инсулина:
- Shc-белки
- p60dok
- Cbl
- APS
- Gab-1
- Они обеспечивают дополнительные остатки тирозина для фосфорилирования тирозинкиназой домена активированного рецептора, который привлекает дополнительные молекулы, содержащие домены SH2 или гомологи плекстрина (PH) .
- Когда PI3Kи его регуляторные белки (p85, p110) связываются с субстратом рецептора инсулина, они также привлекают и активируют следующие молекулы:
- PDK1 (PIP3-зависимая киназа-1)
- Akt (PBK)
- mTORC2
- S6киназы
- PKC
- Также было описано что субстрат рецептора инсулина имеет остатки серина, которые могут быть фосфорилированы
Другие нарушения сигнального пути инсулина:
- Включение липидных и белковых фосфатаз в каскад инсулина и его регуляторных механизмов.
- Ингибирование транскрипции рецептора инсулина и протеолиз при убиквитинировании.
Пути активации рецепторов инсулина и ИФР-1 пересекаются в mTORC1 и mTORC2
- Широко известно, что mTORC1 и mTORC2 обладают возможностью фосфорилирования серина и треонина.
- Также недавно была открыта возможность mTORC2 к фосфорилированию тирозина в составе субстрата рецептора инсулина и тирозинкиназы рецепторов инсулина и ИФР-1
- В это время mTORC1 активизирует S6 киназы, которые фосфорилируют остатки серина в субстрате рецептора инсулина, что в свою очередь ведёт к разобщению рецептора инсулина и его субстратов,
- Считается, что ИФР-1 в высоких концентрациях активирует рецептора инсулина. Точный механизм этого пока что неизвестен, однако возможно это происходит:
- за счёт влияния ИФР-1 на липидный профиль при помощи ингибировании гормона роста и поглощения свободных жирных кислот мышцами;
- возможно имеется вариант сплайсинга рецептора инсулина с недостаточностью 11 экзона, что придаёт сродство рецептору к ИФР-1 и ИФР-2.
- В этом случае, ИФР-1 получает возможность активировать рецептора инсулина и связываться с ИФР-2, без активации тирозинкиназного домена.
- Рецептор ИФР-1 преимущественно активируется ИФР-2.
- ИФР-2 содержит домен KLRB, который блокирует домен тирозинкиназы в цитоплазматической области рецептора инсулина
- ИФР-1 и ИФР-2 имеют различные функции в разных тканях:
- в мышцах:
- ИФР-1 больше связан с поглощением глюкозы;
- ИФР-2 стимулирует MAPK-путь.
- в печени:
- оба инсулиноподобных фактора роста обладают способностью к регуляции метаболизма;
- кроме того, ИФР-2 имеет важную роль в метаболизме липидов.
- в мышцах:
- ИФР-1 более активен в пост-прандиальном периоде, а ИФР-2 — натощак.
- Shc и PLC взаимодействуют только с субстратом рецептора инсулина-2.
- Shc активирует MAPK-путь.
- PLC обладает метаболическими эффектами, связанные с ГЛЮТ4.
- ИФР-1 имеет несколько мест связывания с SHP2 (фосфатазы, связанные с ростом) и, возможно, сильнее способны рекрутировать Cbl (E3 лигазы, связанные с деструкцией и убиквитинированием).
- Это может объяснить другой, независимый от фосфориляциисерина, то есть не чувствительный к метаболическим изменениям.
- Shc активирует MAPK-путь.
- Суммируя все эти данные, необходимо сделать вывод: рецептор ИФР-1 имеет различные сигнальные пути, включающие:
- Поддержание окисления липидов в печени.
- Поглощение свободных жирных кислот в мышцах.
- Через mTORC1 реактивирует рецептор инсулина, через действие тирозинкиназ на ИРС, что вытесняет фосфорилирование серина и активирует сигнальный путь инсулина.
- ИФР-1 при СД 2 типа и метаболическом синдроме определяется в низких количествах, что объясняется
- прекращением ингибирования продукции ИФРСБ-1 в печени
- В соответствии с вышесказанным, предполагается положительный эффект восстановления физиологического уровня ИФР-1 с помощью заместительной терапии.
Механизм действия
IGF-1 является первичным медиатором действия гормона роста (GH). Гормон роста вырабатывается передней долей гипофиза , попадает в кровоток и затем стимулирует печень к выработке IGF-1. Затем IGF-1 стимулирует системный рост организма и оказывает стимулирующее воздействие на почти все клетки тела, особенно на скелетные мышцы , хрящи , кости , печень , почки , нервы , кожу , кроветворные и легочные клетки. Помимо инсулиноподобных эффектов, IGF-1 также может регулировать синтез клеточной ДНК .
IGF-1 связывается с по меньшей мере , две поверхности клеток рецепторных тирозинкиназ : The ИФР-1 – рецептора (IGF1R) и рецептора инсулина . Его основное действие опосредовано связыванием со специфическим рецептором IGF1R, который присутствует на поверхности многих типов клеток во многих тканях. Связывание с IGF1R инициирует внутриклеточную передачу сигналов. IGF-1 является одним из наиболее мощных природных активаторов сигнального пути AKT , стимулятором роста и пролиферации клеток и мощным ингибитором запрограммированной гибели клеток . Рецептор IGF-1, по-видимому, является «физиологическим» рецептором, потому что он связывает IGF-1 со значительно более высоким сродством, чем рецептор инсулина. IGF-1 активирует рецептор инсулина примерно в 0,1 раза сильнее, чем инсулин. Часть этой передачи сигналов может происходить через гетеродимеры IGF1R / рецептора инсулина (причина путаницы в том, что исследования связывания показывают, что IGF1 связывает рецептор инсулина в 100 раз хуже, чем инсулин, но это не коррелирует с фактической эффективностью IGF1 in vivo. при индуцировании фосфорилирования рецептора инсулина и гипогликемии).
IGF-1 связывает и активирует свой собственный рецептор IGF-1R посредством экспрессии на клеточной поверхности рецепторных тирозинкиназ (RTK) и дальнейшего сигнала через многочисленные каскады внутриклеточной трансдукции. IGF-1R является важнейшим ролевым индуктором в модуляции метаболических эффектов IGF-1 на клеточное старение и выживаемость. В локализованной клетке-мишени IGF-1R опосредует паракринную активность. После его активации происходит инициация внутриклеточной передачи сигналов, вызывая множество сигнальных путей. Важный механистический путь, участвующий в посредничестве каскада, влияет на ключевой путь, регулируемый фосфатидилинозитол-3 киназой ( PI3K ) и ее нижележащим партнером, mTOR (мишень рапамицина млекопитающих). Рапамицин связывается с ферментом FKBPP12, подавляя комплекс mTORC1. mTORC2 остается незатронутым и реагирует повышающим регулированием AKT, управляя сигналами через ингибированный mTORC1. Фосфорилирование эукариотического фактора инициации трансляции 4E ( EIF4E ) с помощью mTOR подавляет способность эукариотического фактора инициации трансляции 4E-связывающего белка 1 ( EIF4EBP1 ) ингибировать EIF4E и замедлять метаболизм. Мутация сигнального пути PI3K-AKT-mTOR является важным фактором образования опухолей, обнаруживаемых преимущественно на коже, внутренних органах и вторичных лимфатических узлах (саркома Капоши). IGF-1R позволяет активировать эти сигнальные пути и впоследствии регулирует клеточное долголетие и метаболический повторный захват биогенных веществ. Терапевтический подход, направленный на уменьшение таких скоплений опухолей, может быть вызван ганитумабом. Ганитумаб представляет собой моноклональное антитело (mAb), антагонистически направленное против IGF-1R. Ганитумаб связывается с IGF-1R, предотвращая связывание IGF-1 и последующий запуск сигнального пути PI3K-mTOR; ингибирование этого пути выживания может привести к подавлению роста опухолевых клеток и индукции апоптоза опухолевых клеток.
Инсулиноподобный фактор роста 1 , как было показано , связываются и взаимодействуют со всеми семь IGF-1 связывающих белков (БСИФР): IGFBP1 , IGFBP2 , IGFBP3 , IGFBP4 , IGFBP5 , IGFBP6 и IGFBP7 . Некоторые IGFBP ингибируют. Например, и IGFBP-2, и IGFBP-5 связывают IGF-1 с более высоким сродством, чем он связывает свой рецептор. Следовательно, повышение уровней этих двух IGFBP в сыворотке приводит к снижению активности IGF-1.
Клинические испытания
Рекомбинантный белок
Несколько компаний оценили применение рекомбинантного IGF-1 в клинических испытаниях для лечения диабета 1 типа , диабета 2 типа , бокового амиотрофического склероза , тяжелой ожоговой травмы и миотонической мышечной дистрофии.
Результаты клинических испытаний, оценивающих эффективность IGF-1 при диабете 1 и 2 типа, показали снижение уровня гемоглобина A1C и суточного потребления инсулина. Однако спонсор прекратил программу из-за обострения диабетической ретинопатии , а также смещения корпоративного внимания к онкологии .
Было проведено два клинических исследования IGF-1 для лечения БАС, и хотя одно исследование продемонстрировало эффективность, второе было неоднозначным, и продукт не был представлен на утверждение в FDA.
Насколько доказательны исследования
В различных странах было опубликовано несколько обсервационных исследований потребления молока, молочных продуктов и акне. Возрастные группы – дети, подростки и молодые люди (7–30 лет)11.
Они выявили, что любые молочные продукты, а также цельное молоко, обезжиренное молоко и йогурт независимо от количества выпитого и частоты повышали вероятность появления акне.
Были опубликованы также описательные и систематические обзоры12, метаанализ13.
Однако ряд ученых высказывался неоднозначно относительно доказательной ценности исследований и отмечал ограничения14:
- Субъективные опросники
Ориентировались на оценку самих пациентов, мог отсутствовать подтвержденный врачом диагноз15. - Включение других дерматологических пациентов в качестве контроля16
Ослабляло ассоциации, так как себорея может встречаться и при сопутствующих заболеваниях. - Смещение данных
Участники могли намеренно преувеличивать или недооценивать свое состояние при заполнении опросников. Кроме того, в мета-анализах было невозможно четко различить момент появления воспалительных элементов и тяжесть состояния. Не всегда учитывались иные факторы диеты (например, гликемический индекс, калорийность) или особенности образа жизни17.
Хотя исследования и продемонстрировали положительную связь между потреблением молока и акне, Американская академии дерматологии неохотно внедряла рекомендации по ограничению употребления молокопродуктов, поскольку считала данные недостаточно убедительными18.
Инсулиноподобный фактор роста-1 и метаболизм углеводов
- ИФР-1 повышает захват глюкозы в периферических тканях.
- Экзогенный ИФР-1 снижает уровень глюкозы в плазме крови и у здоровых людей, и у пациентов с СД 1 и 2 типа, а также в общем у людей, резистентных к инсулину
- В исследованиях показано, что при резистентности к инулину повышается количество гибридных рецепторов к инсулину/ИФР-1 в мышечной и жировой тканях
- Высокие дозы ИФР-1 обычно приводят к гипогликемии,
- Несмотря на снижение концентрации циркулирующего в крови инсулина.
- В группе мышей с инактивированными генами рецептора инсулина было показано снижение глюкозы в крови при помощи ИФР-1.
- Что свидетельствует о том, что ИФР-1 действует не только через гибридные рецепторы инсулина на метаболизм углеводов, но и через свои специфические рецепторы.
- Позже было пересмотрено действие ИФР-1 на мышцы и установлено прямое влияние на поглощение глюкозы.
- У мышей с инактивированными генами ИФР-1 в печени развивалась резистентность к инсулину.
- В этих условиях происходило повышение концентрации глюкозы и существенное снижение инсулин-индуцированного аутофосфорилирования рецептора к инсулину и ИРС в скелетных мышцах
- После экзогенного введения ИФР-1 всё восстановилось.
- Можно сделать вывод, что печёночная экспрессия ИФР-1 играет ключевую роль в сигнальном каскаде инсулина в скелетных мышцах и поглощении ими глюкозы
- У мышей с инактивированными генами ИФР-1 в печени развивалась резистентность к инсулину.
- При отсутствии гибридных рецепторов и инактивации рецепторов к ИФР-1 в мышцах возникала резистентность к инсулину и СД 2 типа в раннем возрасте.
- Также, вероятно ИФР-1 влияет на глюконеогенез в почках.
- Кроме того, экспрессия рецепторов ИФР-1 была обнаружена и в печени,
- ИФР-1 снижает уровень гормона роста в плазме крови благодаря отрицательной обратной связи.
- Это ведёт к снижению влияния гормона роста на функции печени, в том числе улучшая чувствительность к инсулину.
- Как и в жировой ткани, так и в печени гормон роста инициирует синтез субъединицыPI3K -p85,
- что ведёт к суппрессии активности p110
- Таким образом, ИФР-1 может косвенно влиять на метаболизм углеводов через
- снижение концентрации гормона роста в плазме крови,
- повышение активности инсулина.
- В постпрандиальный период уровень ИФР-1 в крови увеличивается.
- Свободный ИФР-1 способствует:
- окислению жирный кислот в мышцах,
- подавлению гормона роста,
- стимуляции транспорта глюкозы в мышечную ткань,
- подавлению глюконеогенеза в почках.
- ИФР-1-связывающие белки также играю роль в метаболизме углеводов с помощью влияния на ИФР-1.
- ИФР-1-связывающие белки взаимодействуют с ядерным рецептором RXR-α.
- Тот, в свою очередь, реагирует с PPAR-γ,
- ИФР-1-связывающие белки взаимодействуют с ядерным рецептором RXR-α.
- Повышенная экспрессия ИФР-1-связывающих белков ассоциирована с резистентностью к инсулину.
- В исследовании на мышах с неполной секрецией ИФР-1 было показано снижение экспрессии генов, участвующих в метаболизме глюкозы:
- фосфоенолпируваткарбоксилазы-1,
- глюкозо-6-фосфатазы,
- пируватдегидрогеназыкиназы изофермента-4,
- АТФ-цитратлиазы.
- Что приводило к гипергликемии.
- Эти изменения были купированы заместительной терапией низкими дозами ИФР-1 в течении 10 дней.
- Известно, что инсулин повышает экспрессию данных генов.
- Результаты исследования показывают противоположные инсулину эффекты дефицита ИФР-1.
- Свойства ИФР-1 в данном случае не “инсулиноподобны”, а антагонистичны.
- Кроме того, пируватдегидрогеназыкиназы изофермент-4 кодирует пируватдегидрогеназныйкомплекс (ПДК).
- ПДК является новой мишенью при лечении метаболического синдрома с помощью поддержания стабильного содержания АТФ в клетке.
- Это происходит благодаря эффективному использования свободных жирных кислот и глюкозы с помощью ПДК.
- В исследовании на мышах с неполной секрецией ИФР-1 было показано снижение экспрессии генов, участвующих в метаболизме глюкозы:
Повышение и понижение ИФР
Для взрослого человека повышенный соматомедин действует негативно: вызывает преждевременное старение, и, как следствие, сокращает продолжительность жизни. Высокий инсулиноподобный фактор роста повышает риск сердечно-сосудистых заболеваний, увеличивает нагрузку на печень, почки, приводит к быстрому изнашиванию жизненно важных органов. Кроме того, существует мнение, что высокий уровень гормона приводит к развитию онкологических заболеваний. Соматомедин предотвращает процесс отмирания клеток, в том числе и злокачественных, тем самым стимулируя их увеличение.
Понижение ИФР осуществляется нормализацией гормонального баланса, употреблением лекарств, стимулирующих работу щитовидной железы. Это могут быть препараты на основе йода. Важную роль играет правильное питание. Следует ограничить употребление пищи с высоким содержанием белка: мяса, молочных продуктов, рыбы. Эти продукты также способствуют повышению уровня ИФР. В пищу необходимо употреблять пищу растительного происхождения: овощи, злаки со сбалансированным содержанием белков, жиров и углеводов. Применение витаминно-минеральных комплексов способствует нормализации работы щитовидной железы и снижению инсулиноподобного фактора роста.
В детском организме все устроено наоборот. Если уровень ИФР низкий, то это плохо сказывается, как и на физическом развитии ребенка, так и на его умственных способностях. С каждым годом жизни ребенка повышается и инсулиноподобный фактор роста. Между этими двумя значениями наблюдается линейная зависимость. Рост ИФР продолжается до тех пор, пока организм не перестанет расти, как правило, это происходит при достижении 18-25 лет.
При низком уровне соматомедина устанавливают причину отклонения. Для увеличения показателя, используют витаминные добавки на основе кальция и других минералов, которые помогают формироваться костной ткани и укрепляют ее
Важно уделять особое внимание питанию ребенка: оно должно быть сбалансированным и разнообразным. Предпочтительнее включить в ежедневный рацион употребление в пищу молочной продукции, куриных яиц, красного и белого мяса, крупы. Помимо питания и витаминов, ребенок должен заниматься спортом: это обеспечит формирующиеся мышцы и кости необходимой нагрузкой
При совокупности выполнения всех перечисленных рекомендаций уровень соматомедина быстро придет в норму, а организм ребенка продолжит нормально развиваться. Исключение составляют случаи, когда низкое значение ИФР вызвано отклонениями в работе гипофиза. Для лечения применяют гормональную терапию, она дает эффективный результат и нормализует уровень гормона
Помимо питания и витаминов, ребенок должен заниматься спортом: это обеспечит формирующиеся мышцы и кости необходимой нагрузкой. При совокупности выполнения всех перечисленных рекомендаций уровень соматомедина быстро придет в норму, а организм ребенка продолжит нормально развиваться. Исключение составляют случаи, когда низкое значение ИФР вызвано отклонениями в работе гипофиза. Для лечения применяют гормональную терапию, она дает эффективный результат и нормализует уровень гормона.
Обезжиренное молоко безопасно?
Многие исследования показали, что обезжиренное молоко является более комедогенным, чем цельное молоко. Считается, что во время производства обезжиренного молока происходят изменения активности глюкокортикоидов и TGF-β, что нарушает гормональный баланс молока. Более того, для поддержания надлежащей консистенции производители обезжиренного молока добавляют в него сывороточные белки, такие как α-лактоальбумин, роль которых в комедогенезе также значительна21.
В 2005 году Adebamowo et al. показал, что обезжиренное молоко содержит меньше эстрогена – гормона, который может сдерживать акнегенез. Он также показал, что творог22 как кисломолочный продукт, а также мороженое23, основанные на коровьем молоке, могут провоцировать воспаление.
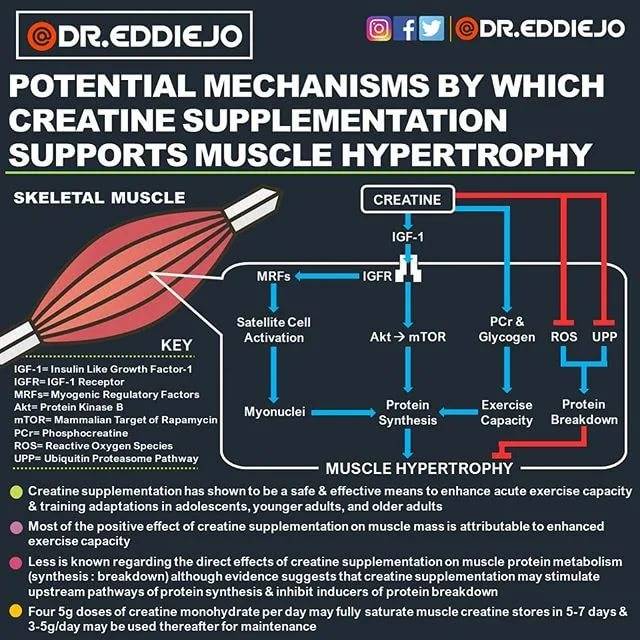
Креатин в мышечных волокнах
Определение
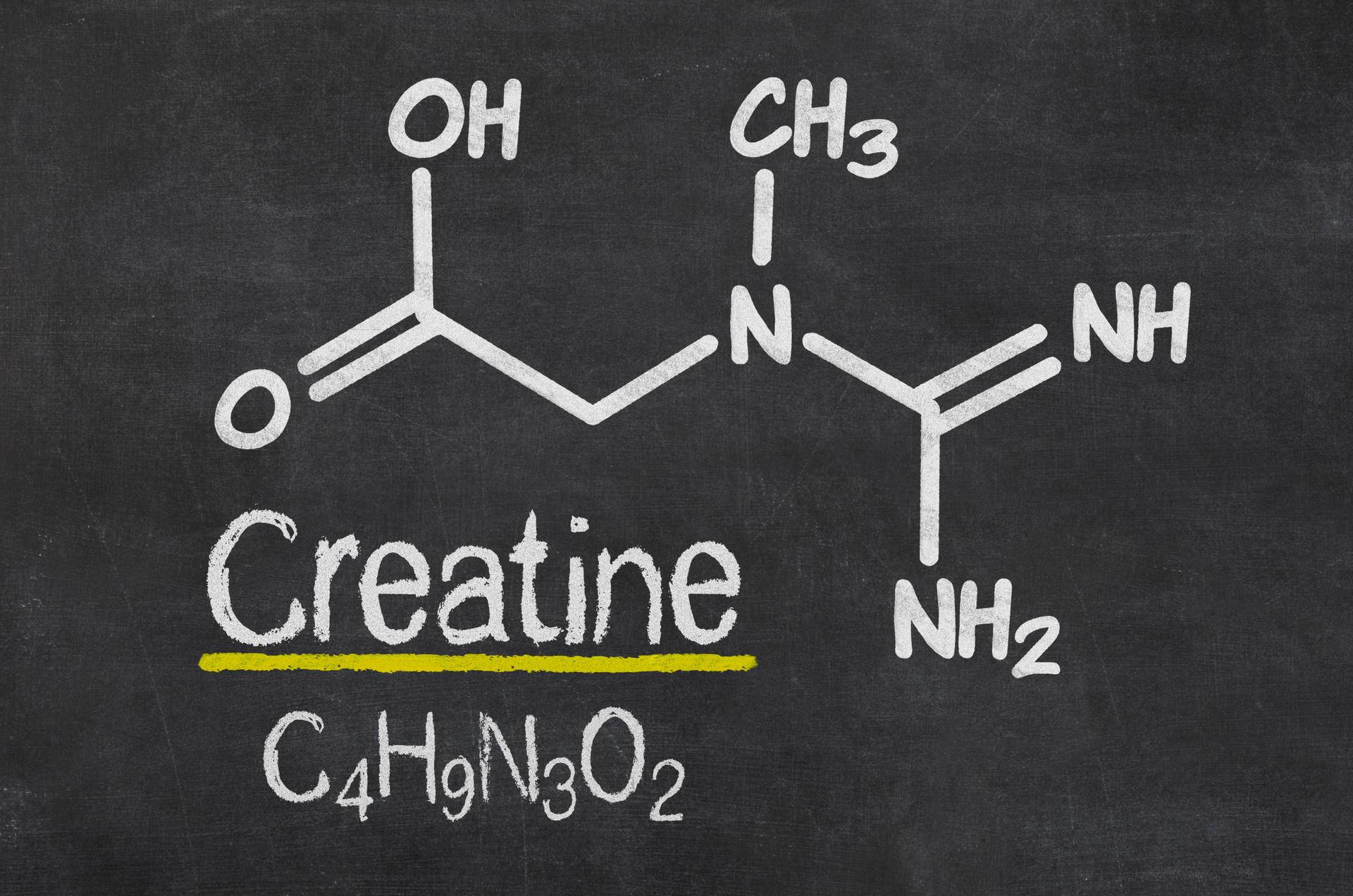
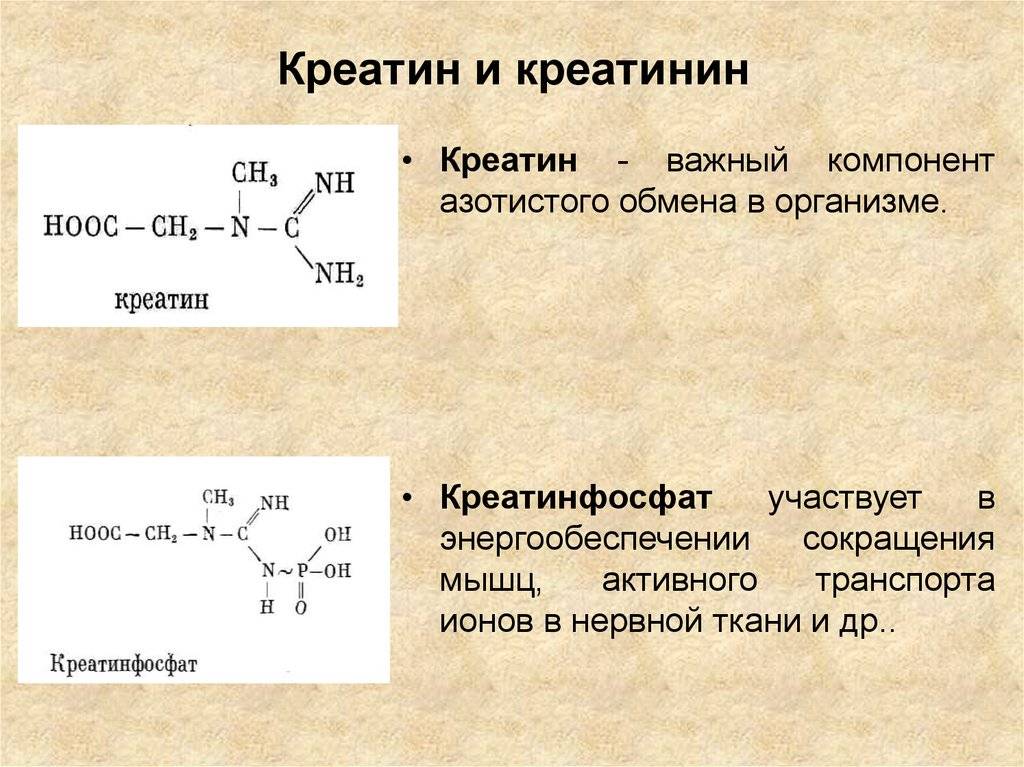
Креатин – это азотсодержащая карбоновая кислота, которая встречается в организме позвоночных. Участвует в энергетическом обмене в мышечных волокнах и нервных клетках.
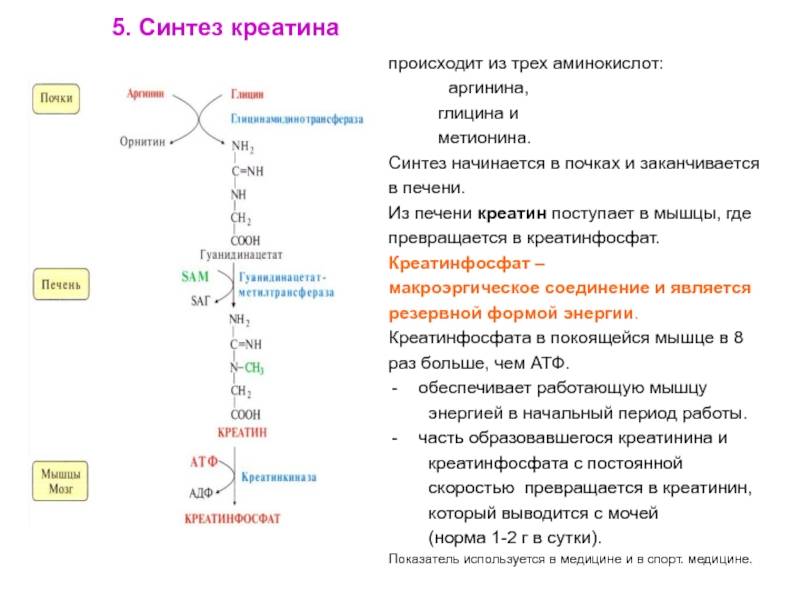
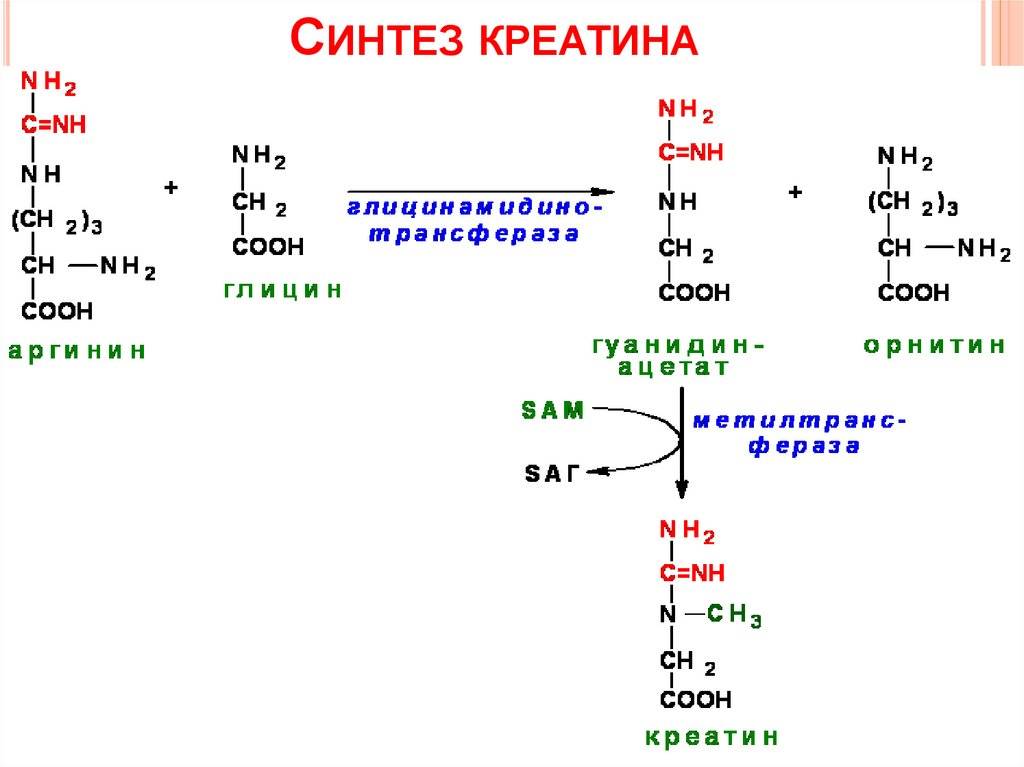
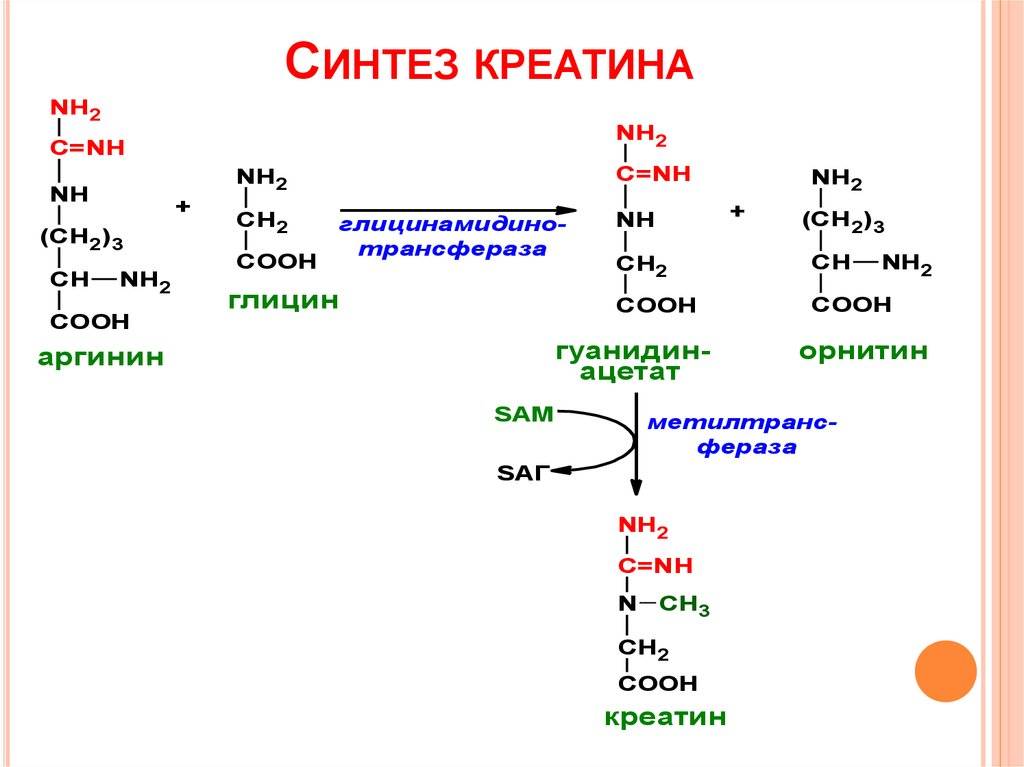
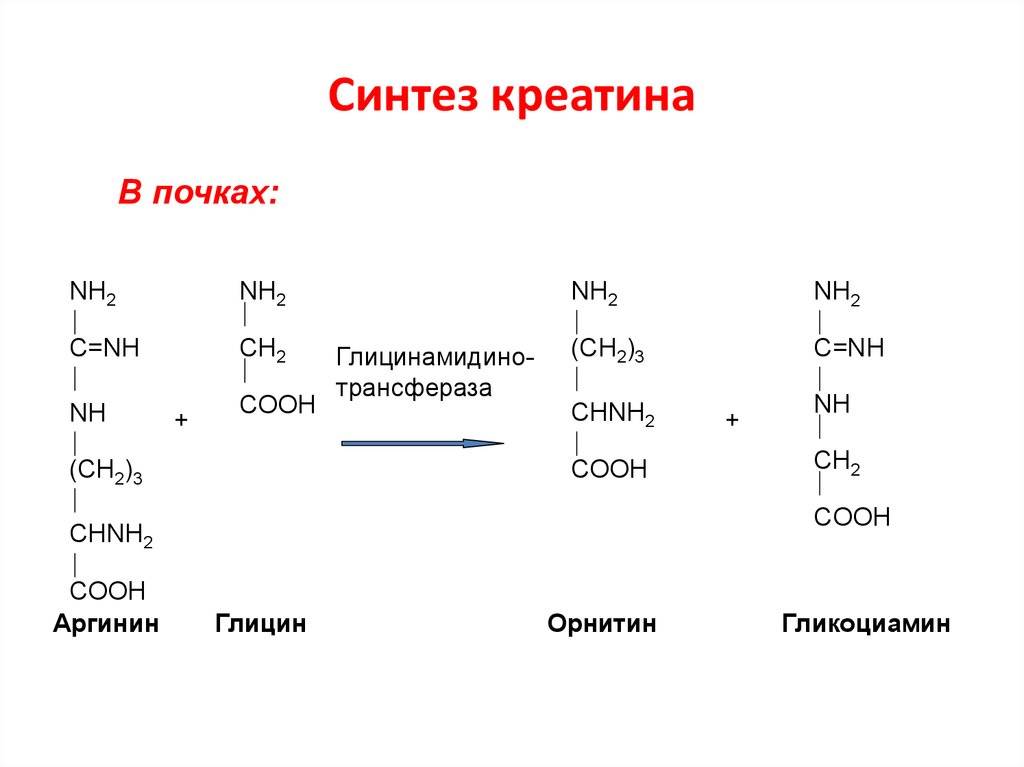
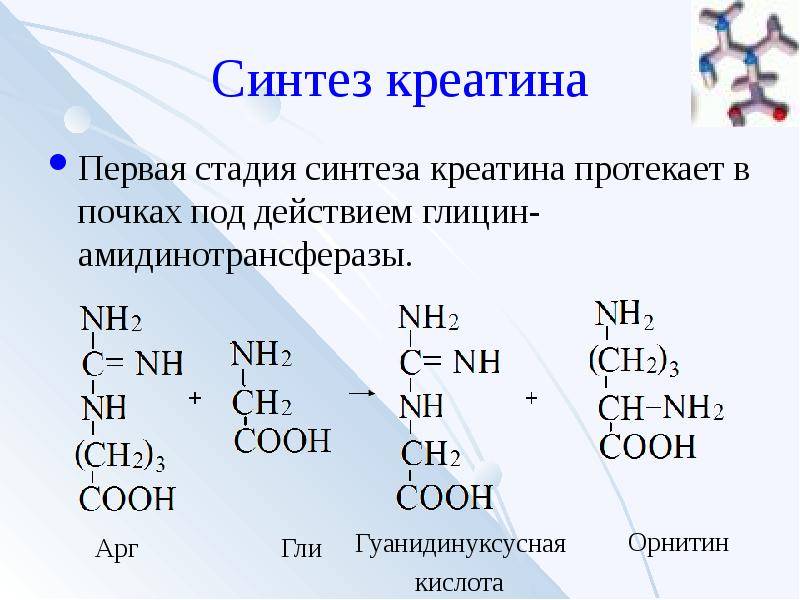
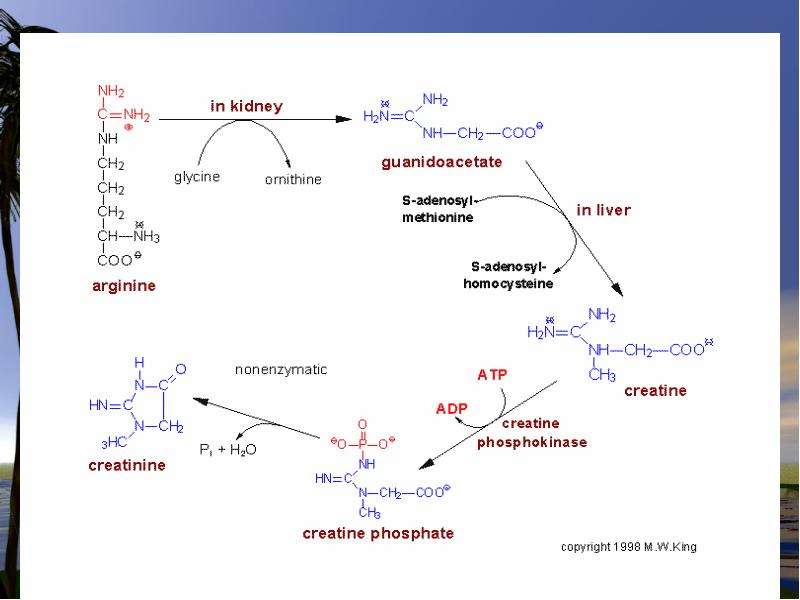
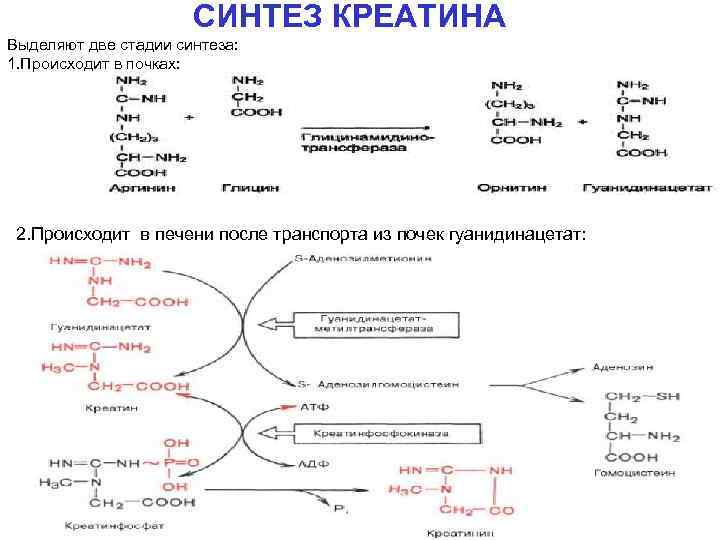
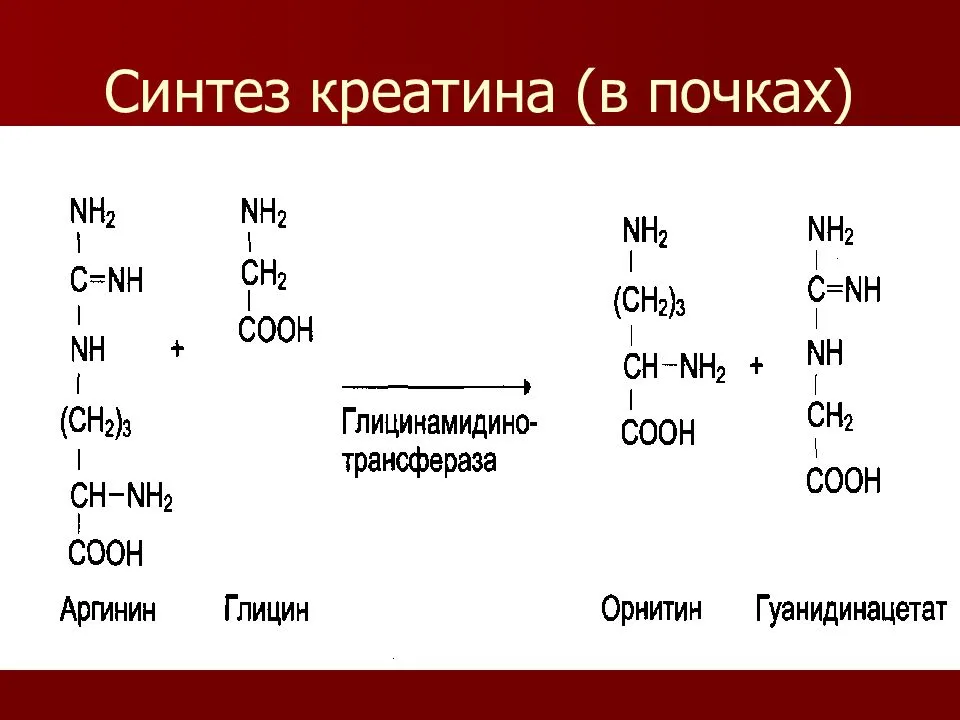
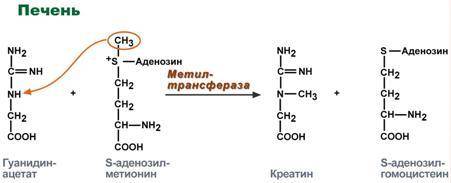
Синтез креатина
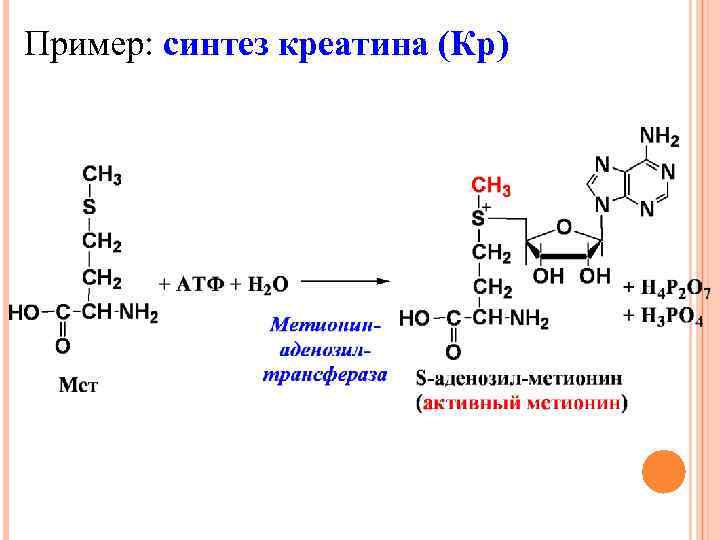
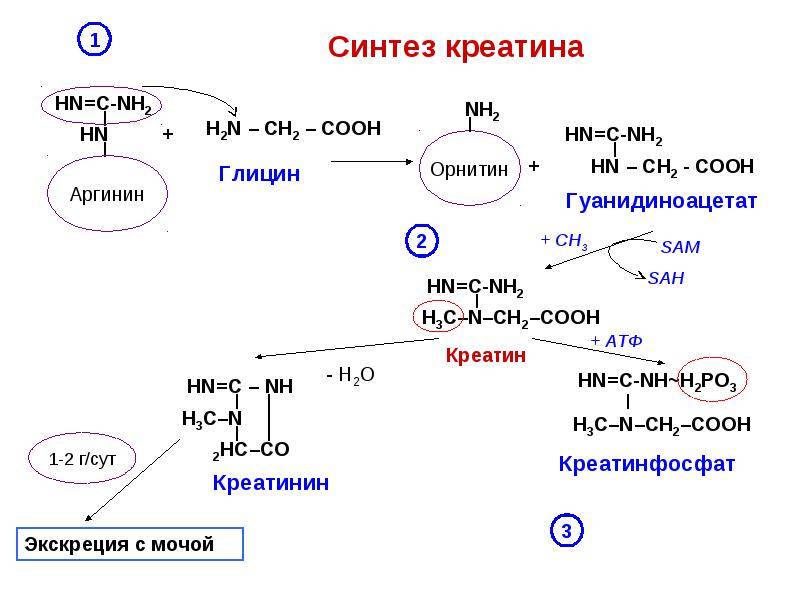
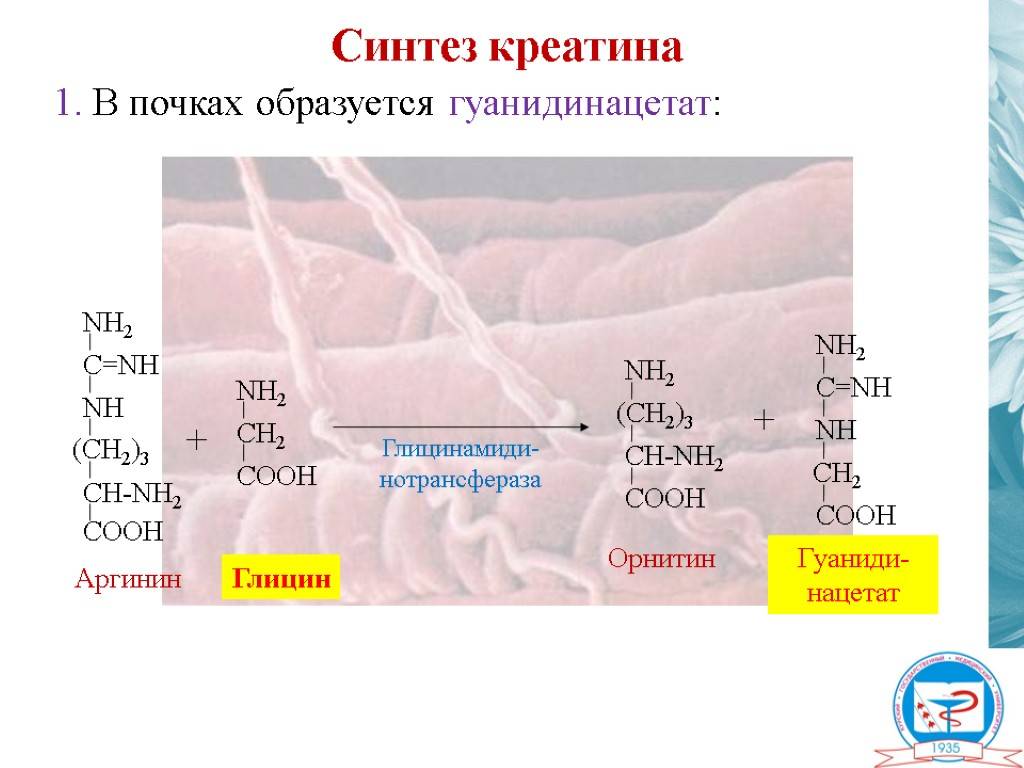
Для синтеза креатина необходимы три аминокислоты (глицин, аргинин и метионин), а также три фермента (L-аргинин: глицин-амидинотрансфераза, гуанидинацетат-метилтрансфераза и метионин-аденозилтрансфераза).
Содержание креатина в скелетных мышцах
В скелетных мышцах в покое содержится 4.0 ммоль/кг сырой массы мышц, при утомлении – 25,0 ммоль/кг сырой массы мышц (Н.И. Волков с соавт, 2000).
Рис.1. Креатин
История
В 1832 году Мишель Эжен Шевроул (Michel Eugène Chevreul) впервые выделил креатин из экстракта скелетных мышц. Позже он назвал кристаллизованный осадок в креатином (от греч. слова κρέας (креас-мясо).
В 1912 году исследователи Гарвардского университета Отто Фолин (Otto Folin) и Уилли Гловер Денис (Willey Glover Denis) нашли доказательства того, что прием креатина может значительно повысить его содержание в скелетных мышцах. Это подтвердили исследования 1920-х годов. Было установлено, что при потреблении большого количества креатина организм человека способен накапливать креатин. Из этого был сделан вывод о том, что креатин является ключевым игроком в метаболизме скелетных мышц.
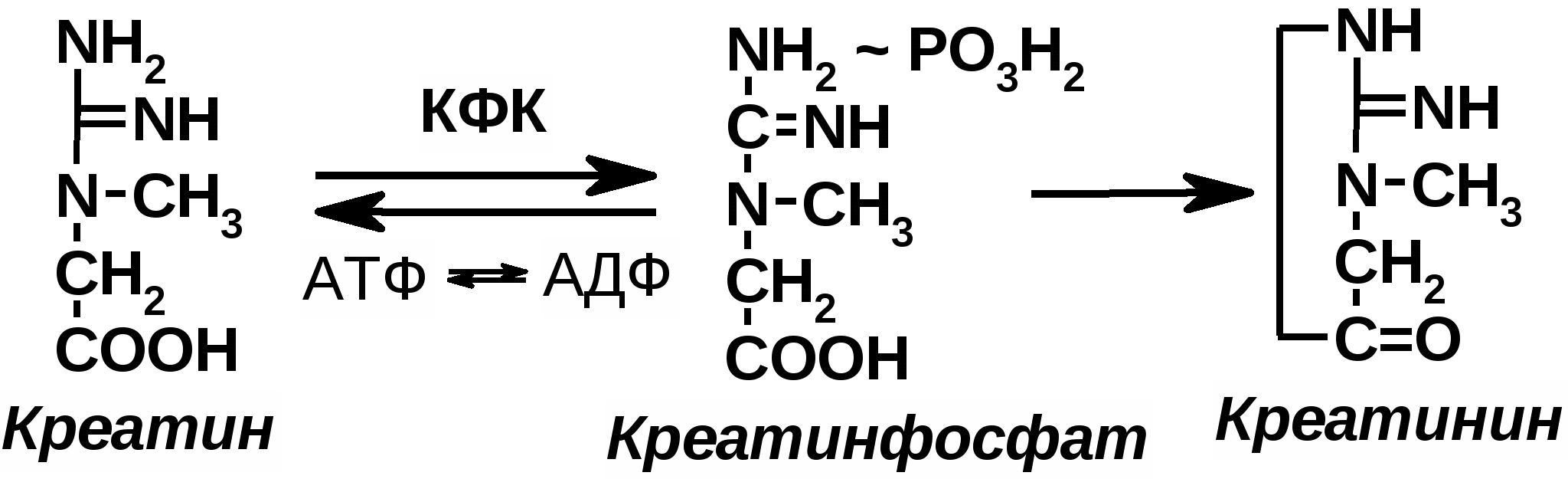
В 1927 году был открыт креатинфосфат (КрФ) – соединение, которое обладает большим запасом энергии. В 1960-х годах было показано, что КрФ легко вступает во взаимодействие с молекулами АДФ. Реакция катализируется ферментом креатинкиназой. На основе этого ученые заключили, что именно АТФ, а не КрФ напрямую потребляется при сокращении мышц.
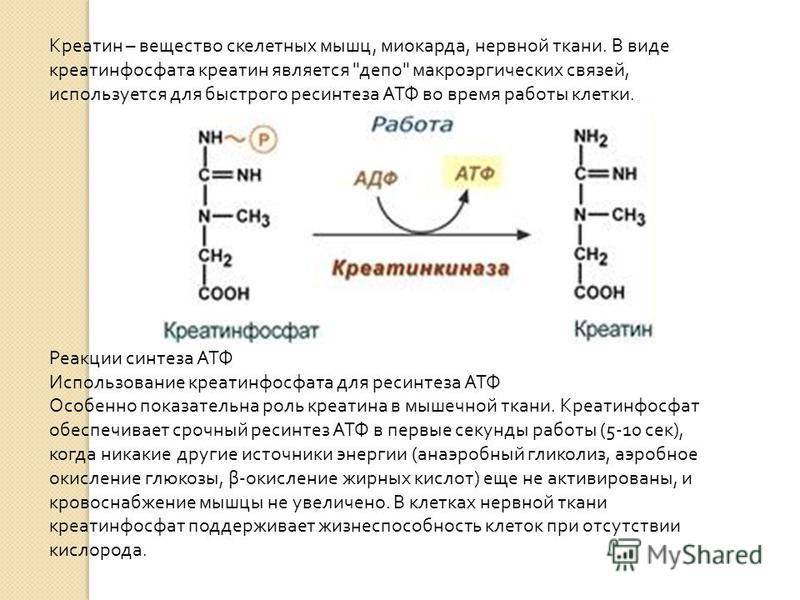
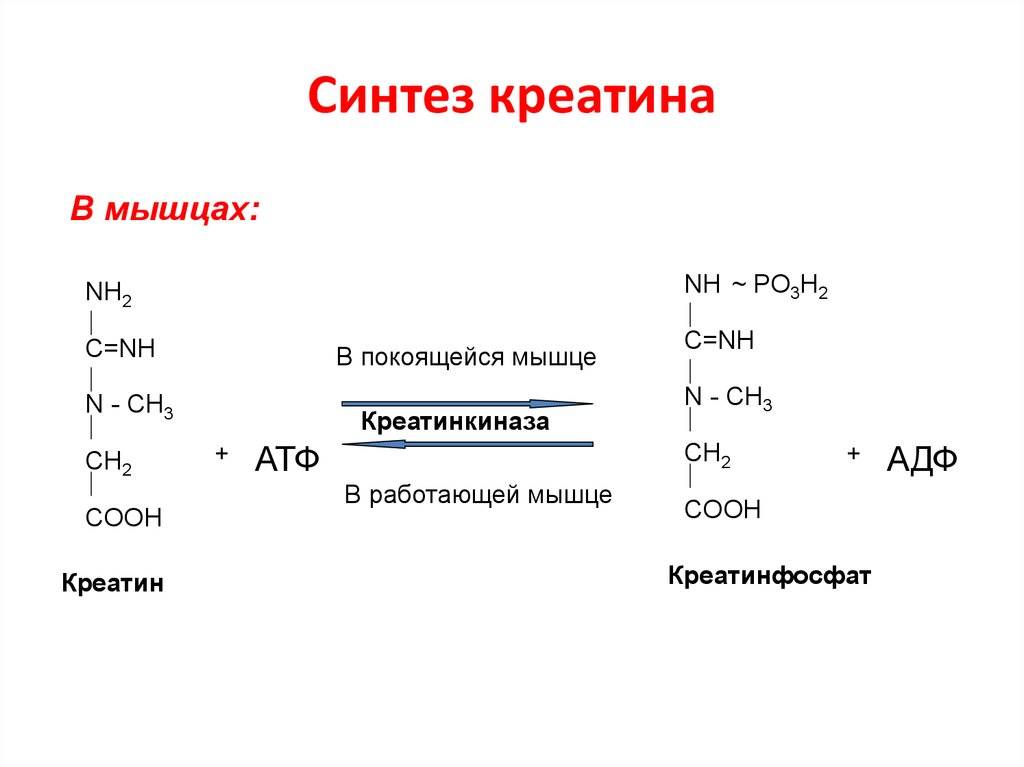
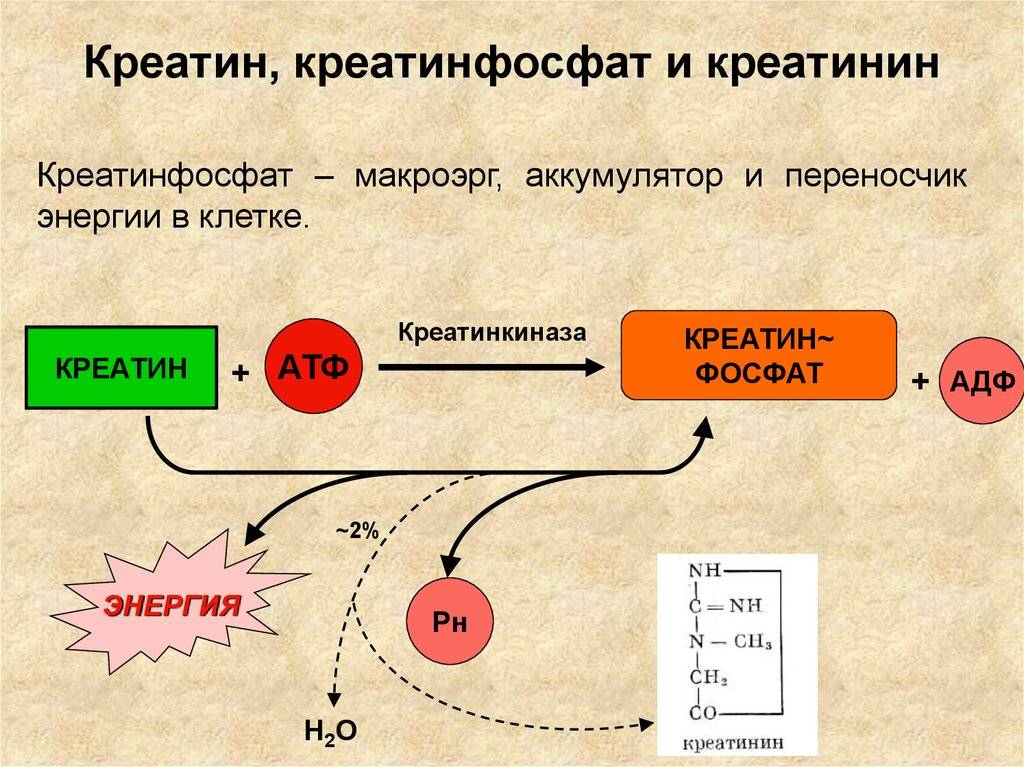
Креатинфосфатный путь ресинтеза АТФ (кретинфосфатная реакция)
При выполнении быстрых, интенсивных движений в скелетных мышцах активно протекает креатинфосфатная реакция (креатинфосфатный путь ресинтеза АТФ). Это самый мощный путь ресинтеза АТФ (рис.2).
Рис.2. Креатинфосфатная реакция
Креатинфосфатная реакция обратима, то есть из креатина может образовываться КрФ (рис.3 слева).
Рис.3
Однако равновесие креатинфосфатной реакции смещено в сторону образования АТФ. Поэтому, как как только в мышечных волокнах появляются первые порции АДФ, эта реакция начинает осуществляться (С.С. Михайлов, 2009).
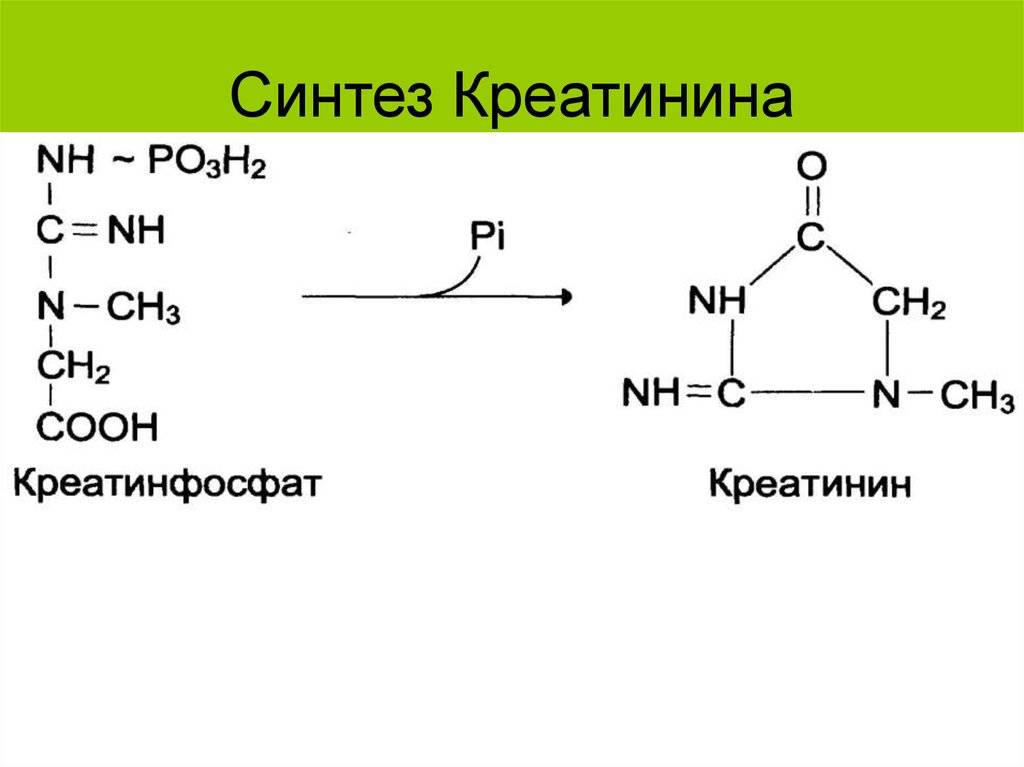
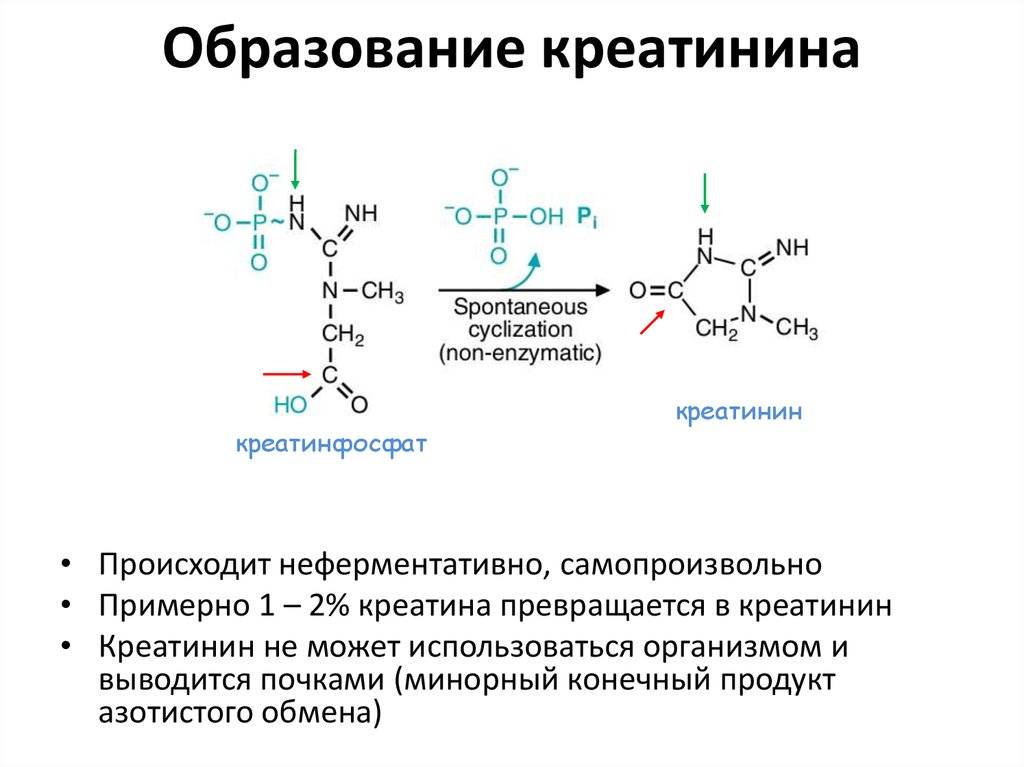
КрФ, обладая большим запасом химической энергии, является веществом непрочным. От него легко отщепляется фосфорная кислота (H3PO4), в результате образуется креатинин. Для протекания этой реакции не нужны ферменты, и она необратима (рис.3 справа). Образовавшийся креатинин выводится из организма с мочой. По его концентрации в моче судят о содержании КрФ в скелетных мышцах (С.С. Михайлов, 2009).
Более подробно строение и функции мышц описаны в моих книгах:
- Гипертрофия скелетных мышц человека
- Биомеханика опорно-двигательного аппарата человека
Применение в спорте
Хотя влияние креатина на физическую работоспособность было хорошо задокументировано с начала двадцатого века, оно стало известно общественности после Олимпиады 1992 года в Барселоне. В статье от 7 августа 1992 года в «Таймс» сообщалось, что Линфорд Кристи, обладатель золотой медали на дистанции 100 метров, использовал креатин перед Олимпиадой. Также применяли креатин Салли Ганнелл, Олимпийская чемпионка в беге на 400 м с барьерами и барьерист Колин Джексон, двукратный чемпион мира и серебряный призер Олимпийских игр 1988 года.
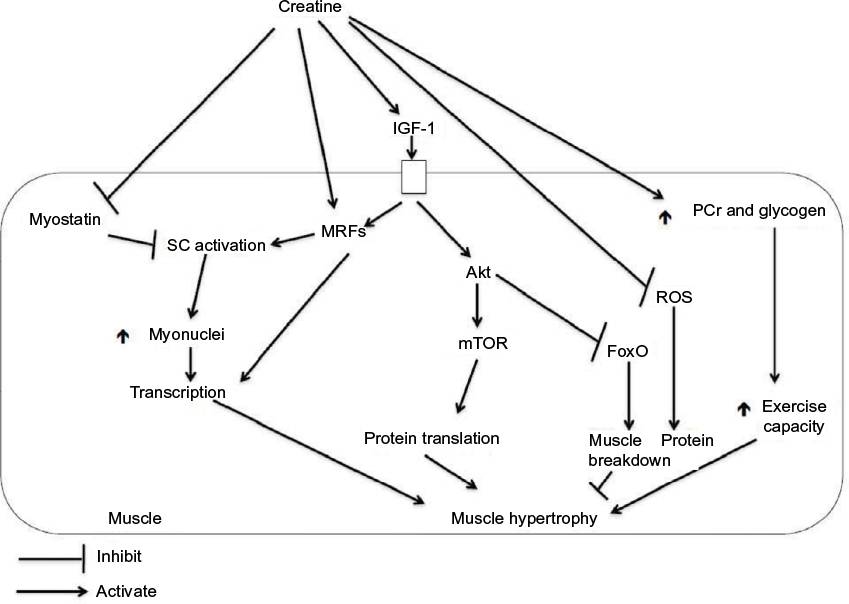
Проведенные в настоящее время научные исследования свидетельствуют о том, что прием креатина значительно повышает физическую работоспособность в скоростно-силовых и силовых видах спорта. В частности, это связано с тем, что прием креатина в сочетании с силовыми тренировками вызывает увеличение количества миоядер и клеток-сателлитов в мышечных волокнах (Olsen S. et al., 2006).
Литература
- Волков Н.И., Несен Э.Н., Осипенко А.А., Корсун С.Н. Биохимия мышечной деятельности. – Киев: Олимпийская литература, 2000.- 504 с.
- Михайлов С.С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
- Olsen S. et al. Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training // J. Physiol. 573.2 (2006) pp 525–534
- Volkov N.I. et al. Ergogenic effects of the creatine supplementation during the training of top-class athletes / In: Current Research in Sport Sciences. An International Perspective / Ed. V.A. Rogozkin, R. Maughan: Plenum Press, New York-London, 1994.- P. 165-172.